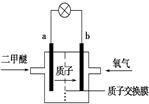
题目内容
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e- ="=" 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
(1)将反应Zn + 2H+ = Zn2+ + H2↑拆写为两个“半反应式”:其中,氧化反应为: 。
(2)由题(1)反应,设计成原电池如图所示:
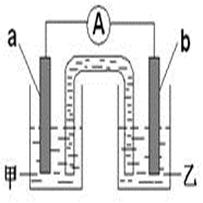
若电极a为Zn ,电极b可选择材料: (只填一种);电解质溶液甲是 ;电极b处的电极反应式: 。
(3)由反应2H2 + O2 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。
(1)将反应Zn + 2H+ = Zn2+ + H2↑拆写为两个“半反应式”:其中,氧化反应为: 。
(2)由题(1)反应,设计成原电池如图所示:

若电极a为Zn ,电极b可选择材料: (只填一种);电解质溶液甲是 ;电极b处的电极反应式: 。
(3)由反应2H2 + O2
 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。(1)Zn-2e-= Zn2+(2分)
(2)Cu(合理给1分),ZnSO4(1分),2H+ + 2e- = H2↑(2分).
(3)负极:2H2 - 4e- = 4H+ ,正极:O2 + 4H+ + 4e- = 2H2O(4分)
(2)Cu(合理给1分),ZnSO4(1分),2H+ + 2e- = H2↑(2分).
(3)负极:2H2 - 4e- = 4H+ ,正极:O2 + 4H+ + 4e- = 2H2O(4分)
试题分析:(1)依据题意,由2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e-==2Fe2+ ,可得:反应Zn + 2H+ = Zn2+ + H2↑拆写为两个“半反应式”,氧化反应为Zn失去2e-生成Zn2+,故氧化反应式为:Zn-2e-= Zn2+;
(2)如图,组成的原电池中若电极a为Zn ,则电解质溶液应为ZnSO4 ,电极b选择材料的化学性质应比锌不活泼,可为Cu或C,则电解质溶液已为稀H2SO4,故电极b处的电极反应式为:2H+ + 2e- = H2↑
(3)根据反应2H2 + O2
 2H2O ,以稀硫酸为电解质溶液设计的燃料电池,其中负极的电极反应式为:2H2 - 4e- = 4H+ ,正极的电极反应式为:O2 + 4H+ + 4e- = 2H2O;
2H2O ,以稀硫酸为电解质溶液设计的燃料电池,其中负极的电极反应式为:2H2 - 4e- = 4H+ ,正极的电极反应式为:O2 + 4H+ + 4e- = 2H2O;点评:该题是中等难度的试题,也是高考中的常见考点。试题注重基础,侧重能力的训练。该题的关键是明确原电池的工作原理,然后结合同样灵活运用、分析、判断即可。

练习册系列答案
相关题目
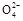 只向PbO2处移动
只向PbO2处移动 )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。 可制取甲醇,其反应为:
可制取甲醇,其反应为:

 的
的  晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
 氧化成
氧化成 ,然后以
,然后以
 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L