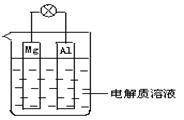
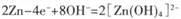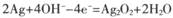题目内容
已知铅蓄电池放电过程可以表示为PbO2 + 2 H2SO4 + Pb="2" PbSO4 + 2H2O下列关于铅蓄电池的说法正确的是
| A.Pb为正极,PbO2为负极 |
| B.正极电极反应式为PbO2 + SO4 2- + 2H+ =PbSO4 + H2O |
| C.硫酸溶液中,H+移向负极 |
| D.放电一段时间后,SO4 2-浓度减小 |
D
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,因此根据总的方程式可知,Pb是还原剂,失去电子,因此负极是Pb,正极是二氧化铅,A不正确;正极得到电子,发生还原反应,因此选项B不正确,应该是PbO2 +2e-+SO4 2- + 4H+ =PbSO4 + 2H2O;原电池中阳离子向正极移动,C不正确;反应中消耗SO4 2-,因此放电一段时间后,SO4 2-浓度减小,D正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题紧扣教材,侧重对学生基础知识对巩固和训练。该题的关键是明确原电池的工作原理,然后再结合题意灵活运用即可。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
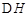 =-2830kJ·mol-1
=-2830kJ·mol-1

 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。