题目内容
【题目】表中是食用碘盐包装上的部分说明,下列说法正确的是配料( )
配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
碘含量 | 35±15 mg/kg |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A. 高温会导致碘的损失 B. 碘酸钾可氧化氯化钠
C. 可用淀粉检验碘盐中的碘酸钾 D. 该碘盐中碘含量是指碘酸钾的含量
【答案】A
【解析】
试题KIO3高温分解,会导致碘的损失,故A正确;碘酸钾、氯化钠不反应,故B错误;碘单质能使淀粉变蓝,碘酸钾不能使淀粉变蓝,故C错误;碘盐中碘含量是指碘元素的含量,故D错误。

 53随堂测系列答案
53随堂测系列答案【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ、某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
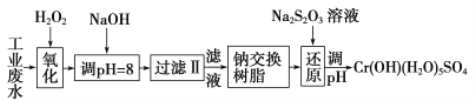
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是_________(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是________(填序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+ E.Fe2+
Ⅱ、酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。

(1)电解时能否用Cu电极来代替阳极上的Fe电极?____(填“能”或“不能”)。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为:________________________。


