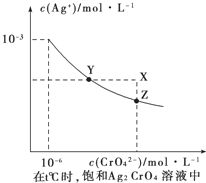
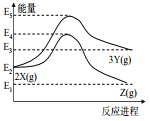
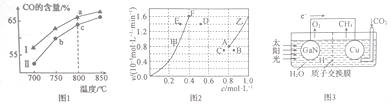
题目内容
【题目】铁片与稀硫酸反应制氢气,下列措施不能使氢气生成速率加大的是( )
A.加热B.用铁粉代替铁片
C.滴加适量CuSO4溶液D.用98%的浓硫酸代替稀硫酸
【答案】D
【解析】
A.加热,增大了活化分子的百分数,反应速率增大,A不符合题意;
B.不用铁片,改用铁粉,固体表面积增大,反应速率增大,B不符合题意;
C.加入硫酸铜溶液,铁置换出铜,形成原电池反应,反应速率增大,C不符合题意;
D.因浓硫酸具有强氧化性,在室温下铁遇浓硫酸会发生钝化,而不生成氢气,D符合题意;
故合理选项是D。

练习册系列答案
相关题目