题目内容
【题目】氯化钴(CoCl2)可溶于水,常用作湿度和水分的指示剂,工业上也可用于制取钴。
(1)钴元素的常见化合价与铁元素相同。往CoCl2溶液中加入NaOH溶液产生粉红色沉淀,露置于空气中一段时间后,沉淀变为棕褐色。
① 化合态钴的常见化合价有_______。
② 沉淀由粉红色变为棕褐色反应的化学方程式为_______________。
(2)将CoCl2溶于浓盐酸中能形成[CoCl4]2-,溶液中存在平衡:[Co(H2O)6]2++4Cl-![]() [CoCl2]2-+6H2O
[CoCl2]2-+6H2O
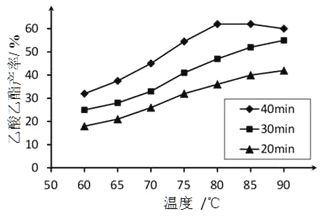
T1℃时,将0.025mol CoCl2·6H2O溶于50mL 12mol/L浓盐酸中,再加水稀释至100 mL。溶液中c(Cl-)与温度(T)的关系如右图所示。

① Tl ℃时,取10mL上述溶液稀释至l00mL,稀释后的溶液中c(Cl-)______0.6mol·L-1(填“>”“=”或“<”)。
② 由图可知,上述反应的△H______0(填“>”“=”或“<”)。
③ 根据A点数据,计算出T1℃时上述反应的平衡常数为________。
(3)采用下图所示装置(Ti-Ru电极为惰性电极)电解CoCl2溶液制取钴。Co能与强酸反应产生H2,不利于Co的沉积,故电解过程中,CoCl2溶液的pH通常控制在3.9~4.2。

① Co沉积在_______(填“Ti-Ru”或“Ti”) 电极上。
② CoCl2溶液中常含有少量Cu2+、Fe3+、Na+等,为提高产品的纯度和电流效率,电解前必须将其中的_______(填离子符号)除去。
③ 若用CoSO4溶液代替CoCl2溶液,会使产率降低。其原因是_____________。
【答案】 +2、+3 4Co(OH)2+2H2O+O2=4Co(OH)3 > > 7.72×10-4(mol/L)-4 Ti Cu2+、Fe3+ OH-在阳极放电,使溶液的pH降低
【解析】(1)①钴元素的常见化合价与铁元素相同,因此化合态钴的常见化合价有+2、+3价。②沉淀由粉红色变为棕褐色,说明+2价Co被氧化为+3价,反应的化学方程式为4Co(OH)2+2H2O+O2=4Co(OH)3。(2)①Tl ℃时,取10mL上述溶液稀释至l00mL,稀释向逆反应方向进行,则稀释后的溶液中c(Cl-)>0.6mol·L-1。②由图可知,升高温度氯离子浓度降低,则升高温度平衡向正反应方向进行,所以上述反应的△H>0。③根据方程式可知
[Co(H2O)6]2++4Cl-![]() [CoCl2]2-+6H2O
[CoCl2]2-+6H2O
起始浓度(mol/L) 0.25 6.5 0
转化浓度(mol/L) 0.125 0.5 0.125
平衡浓度(mol/L) 0.125 6 0.125
因此T1℃时上述反应的平衡常数为![]() 。
。
(3)①Co2+在阴极得到电子,Ti电极与电源负极相连,是阴极,因此Co沉积在Ti电极上。②Co能与强酸反应产生H2,说明金属性较强,因此Cu2+、Fe3+的氧化性强于Co2+,所以电解前必须将其中的Cu2+、Fe3+除去。③若用CoSO4溶液代替CoCl2溶液,OH-在阳极放电,使溶液的pH降低,导致产率降低。