题目内容
【题目】如图曲线 a 和 b 是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )。
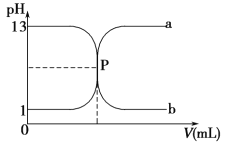
A.盐酸的物质的量浓度为 1 mol·L-1
B.P 点时恰好完全中和,溶液呈中性
C.曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
【答案】B
【解析】
试题分析:A、根据曲线可以看出盐酸溶液的pH=1,pH=-lgc(H+)=1,所以c(HCl)=c(H+)=0.1mol/L,A错误;B、根据曲线可以看出P点时pH=7,说明溶液呈中性,反应恰好完全,B正确;C、曲线a的pH是由小到大,说明是氢氧化钠溶液滴定盐酸溶液的曲线,C错误;D、氢氧化钠与盐酸恰好反应时溶液呈中性,可用酚酞或甲基橙做指示剂,D错误;答案选B。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目