题目内容
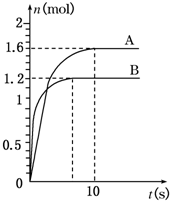
15.下表列出了一些反应在使用催化剂前后的活化能的数据以及化学反应速率常数之比.| 化学反应 | 催化剂 | Ea/KJ•mol-1 | k(催)/k(无) | |
| 无催化剂 | 有催化剂 | |||
| C12H22O11(蔗糖)+H2O═ C6H12O6 (葡萄糖)+C6H12O6(果糖) | 蔗糖酶 | 107 | 36 | 9.2×1011(310K) |
| 2HI═H2+I2 | 金 | 184 | 105 | 1.6×108(503K) |
| CH3CHO═CH4+CO | 碘 | 210 | 136 | 7.5×104(793K) |
| 2H2O2═2H2O+O2 | 过氧化氢酶 | 75 | 25 | 5.8×108(298K) |
分析 由图中数据分析,催化剂是通过参与反应减小反应的活化能来提高化学反应速率,但不能提高化学反应的平衡常数和改变平衡转换率.
解答 解:由图中数据分析,催化剂是通过参与反应减小反应的活化能来提高化学反应速率,但不能改变平衡移动,所以不能提高化学反应的平衡常数和改变平衡转换率,故答案为:加快;不能;不能.
点评 催化剂的定义可这样记忆:“一变二不变”指:一变指:改变其他物质的化学反应速率;二不变指:催化剂的质量和化学性质不变.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下.
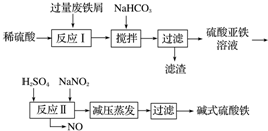
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示.
回答下列问题.
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al(OH)3沉淀,该工艺中“搅拌”的作用是使反应物充分接触反应.
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al(OH)3沉淀,该工艺中“搅拌”的作用是使反应物充分接触反应.
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
6.(s已知在25℃时:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3J•mol-,C(石墨)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1 H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8kJ•mol-则由石墨生成甲烷的反应热△H为:C石墨)+2H2(g)=CH4(g)△H=( )
| A. | -74.8kJ.mol-1 | B. | +74.8kJ.mol-1 | C. | -149.6kJ.mol-1 | D. | +149.6kJ.mol-1 |
10.在常温下,发生下列几种反应
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
②Cl2+2NaBr═2NaCl+Br2
③Br2+2FeBr2═2FeBr3根据上述反应,下列结论正确( )
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
②Cl2+2NaBr═2NaCl+Br2
③Br2+2FeBr2═2FeBr3根据上述反应,下列结论正确( )
| A. | 反应③中Br2 是氧化剂,溴元素被氧化 | |
| B. | 氧化性强弱顺序为:MnO4->Cl2>Fe3+>Br2 | |
| C. | 反应①中,被氧化的HCl占参加反应的HCl的5/8 | |
| D. | 溶液中可发生反应:2Fe3++2Cl-=2Fe2++Cl2↑ |
20.水的摩尔质量和N的相对原子质量分别是( )
| A. | 18和15 | B. | 18g和14 | C. | 18g/mol和14 | D. | 18g/mol和15 |
7.下列反应的离子方程式书写中,正确的是( )
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ |
5.如图实验装置不能达到实验目的是( )
| A. |  比较非金属性强弱:S>C>Si 比较非金属性强弱:S>C>Si | B. | 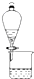 分离CH3COOC2H5和饱和碳酸钠溶液 分离CH3COOC2H5和饱和碳酸钠溶液 | ||
| C. |  观察纯碱的焰色反应 观察纯碱的焰色反应 | D. | 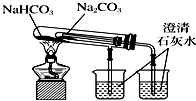 比较Na2CO3和NaHCO3的热稳定性 |