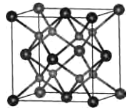
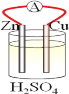
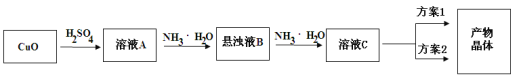
题目内容
【题目】下列说法错误的是
A.用化学平衡移动原理的知识可以解释用排饱和食盐水收集Cl2的原因
B.工业上合成氨,平衡时将氨气液化分离,平衡向右移动,有利于提高H2的转化率
C.在硫酸工业中,三氧化硫的吸收阶段,吸收塔里要装填瓷环,以增大气液接触面积,使SO3的吸收速率增大
D.汽车尾气中的NO和CO缓慢反应生成N2和CO2,为加快该化学反应的速率,最符合实际的措施是升高温度
【答案】D
【解析】
A.Cl2在水中存在平衡:Cl2+H2O![]() H++Cl-+HClO。若水中含有NaCl,则NaCl电离产生的Cl-使生成物的浓度增大,平衡逆向移动,可以减小Cl2的溶解及反应,故A正确;
H++Cl-+HClO。若水中含有NaCl,则NaCl电离产生的Cl-使生成物的浓度增大,平衡逆向移动,可以减小Cl2的溶解及反应,故A正确;
B. 减小生成物的浓度,平衡正向移动,工业上合成氨,平衡时将氨气液化分离,平衡向右移动,有利于提高H2的转化率,故B正确;
C. 增大接触面积加快反应速率,在硫酸工业中,三氧化硫的吸收阶段,吸收塔里要装填瓷环,以增大气液接触面积,使SO3的吸收速率增大,故C正确;
D. 汽车尾气中的NO和CO缓慢反应生成N2和CO2,为加快该化学反应的速率,最符合实际的措施是使用高效催化剂,故D错误;
答案选D。

【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
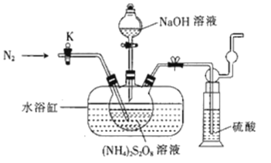
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。