题目内容
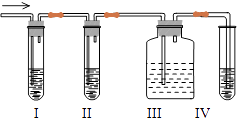
【题目】有关下列各装置图的叙述,不正确的是( )
A. 装置①可用于吸收实验中多余的Cl2
B. 装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C. 装置③中X为煤油,可用于吸收氨气或氯化氢
D. 装置④可用于收集氨气,并吸收多余的氨气
【答案】C
【解析】A.氯气有毒,可用氢氧化钠溶液吸收实验中多余的Cl2,A正确;B.a进气可收集密度比空气大的气体,b进入可收集密度比空气小的气体,则装置②可用于收集H2、NH3、Cl2、HCl、NO2等,B正确;C.X为煤油,密度比水的小,则X在上层,不能隔绝气体和水,X应为四氯化碳,C错误;D.碱石灰可干燥氨气,氨气的密度比空气密度小,易溶于水,则图④中可用于收集氨气,并吸收多余的氨气,D正确;答案选C。

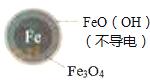
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.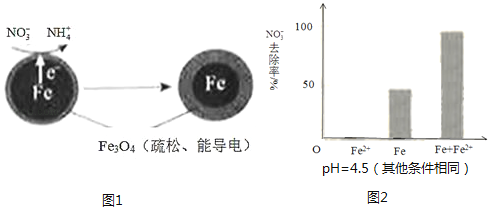
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于25μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___(填“属于”,“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为___(填酸”、“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=_______mol/L。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
___ClO2-+__NO+____=___Cl-+___NO3-+___,________________
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式___________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是___________。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO化学方程式_______________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为_______________。