题目内容
【题目】I、硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验并回答:
如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c 三个棉球变化如下表(认为所产生的气体与棉球上的试剂均得到充分的反应)。则浓硫酸在该反应中表现的性质_________________;
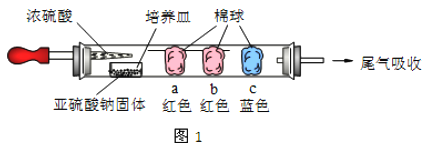
棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
a | ___________ | 棉球变白,微热后又恢复红色 | 该气体具有______性。 |
b | 含酚酞的NaOH 溶液 | 棉球变为白色 | 离子方程式_________ |
c | __________ | 棉球变为白色 | 化学方程式___________,该气体具有_______性。 |
II.通常情况下,向硫酸亚铁溶液中滴加氢氧化钠溶液时,生成的白色絮状沉淀会迅速变为_____色,最终变为____色写出上述白色絮状沉淀变化过程的化学方程式_______;
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一: 用不含O2的蒸馏水配制的NaOH 溶液与硫酸亚铁反应制备。
(1)除去蒸馏水中溶解的O2常采用_________的方法。
(2)生成白色Fe(OH)2 沉淀的操作是用长滴管吸取不含O2的NaOH 溶液,插入FeSO4溶液液面下,再挤出NaOH 溶液。
方法二: 如右图装置中,用NaOH 溶液、铁屑、稀H2SO4等试剂制备。
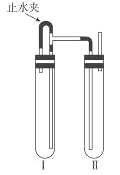
(1)在试管I里加入的试剂是___________。
(2)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后,检验试管II出口处排出的氢气的纯度。当排出的氢气纯净时,再________(如何操作)。这样生成的Fe(OH)2 沉淀能较长时间保持白色。原因是____________。
【答案】 酸性 品红溶液 漂白 SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O也可以) 碘与淀粉的混合溶液(含淀粉的碘水) SO2+I2 + 2H2O=H2SO4+2HI 还原 灰绿色 红褐色 【答题空10】4Fe(OH)2 + O2 + 2H2O==4Fe(OH)3 煮沸 稀硫酸、铁屑 关闭止水夹 氢气充满了试管1和II,隔绝空气(或外界空气不容易进入);
【解析】I、将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,二者反应生成硫酸钠、二氧化硫和水,有硫酸盐生成,因此浓硫酸在该反应中表现的性质是酸性;品红溶液是红色的,二氧化硫能使品红褪色,漂白原理是:SO2与品红溶液反应生成无色不稳定物质,遇热分解又生成SO2,溶液又恢复红色;氢氧化钠遇到酚酞也是红色的,二氧化硫是酸性氧化物,与氢氧化钠溶液反应导致红色消失,离子方程式为SO2+OH-=HSO3-或SO2+2OH-=SO32-+H2O;碘单质遇到淀粉变为蓝色,二氧化硫能将碘单质还原为碘离子:SO2+I2 + 2H2O=H2SO4+2HI,从而使蓝色消失;
II.通常情况下,向硫酸亚铁溶液中滴加氢氧化钠溶液时,生成的白色絮状沉淀会迅速变为灰绿色,最终变为红褐色,这是由于氢氧化亚铁易被氧化为氢氧化铁:4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3;气体的溶解度随温度的升高而降低,除去蒸馏水中溶解的O2常采用煮沸的方法。
方法二:该方法的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气,防止空气中的氧气把二价铁氧化为三价铁。确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NaOH溶液中去,从而使产生的白色Fe(OH)2沉淀在H2的还原性气氛中得以较长时间保持。所以(1)在试管Ⅰ里加入的试剂是稀H2SO4和铁屑,目的是通过二者反应生成氢气;(2)在试管Ⅱ里加入的试剂是NaOH溶液,目的是让它与试管Ⅰ中生成的硫酸亚铁反应,生成氢氧化亚铁沉淀;在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:先检验试管Ⅱ出口处排出的氢气的纯度,防止装置中仍有空气.当排出的H2纯净时,再夹紧止水夹,以便产生高压,把硫酸亚铁溶液压入氢氧化钠溶液中;由于氢气充满了试管1和II,隔绝空气(或外界空气不容易进入),所以Fe(OH)2沉淀能较长时间保持白色。

【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于25μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___(填“属于”,“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为___(填酸”、“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=_______mol/L。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
___ClO2-+__NO+____=___Cl-+___NO3-+___,________________
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式___________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是___________。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO化学方程式_______________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为_______________。
【题目】已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是

选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝色 | Cl2具有氧化性 |