题目内容
15.下列物质中:①Fe ②H2 ③盐酸 ④HCl ⑤SO2 ⑥乙醇 ⑦蔗糖 ⑧NaOH ⑨NaCl ⑩BaSO4,属于电解质的是④⑧⑨⑩;属于非电解质的是⑤⑥⑦;既不是电解质也不是非电解质的是①②③.分析 物质导电的条件是存在自由电子或者自由移动的离子;
在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等).
单质既不是电解质也不是非电解质.
解答 解:①Fe是单质,既不是电解质也不是非电解质;
②H2是单质,既不是电解质也不是非电解质;
③盐酸是HCl的水溶液,是混合物,既不是电解质也不是非电解质;
④HCl溶于水能导电,故为电解质;
⑤SO2 在熔融状态下不导电,溶于水后能导电是由于和水反应生成亚硫酸的原因,和其本身无关,故为非电解质;
⑥乙醇在熔融状态不导电,在水溶液中也不导电,故为非电解质;
⑦蔗糖在熔融状态不导电,在水溶液中也不导电,故为非电解质;
⑧NaOH在水溶液中和熔融状态下均能导电,故为电解质;
⑨NaCl在水溶液中和熔融状态下均能导电,故为电解质;
⑩BaSO4在水溶液中和熔融状态下均能导电,故为电解质;
故答案为:④⑧⑨⑩;⑤⑥⑦;①②③.
点评 本题考查了电解质、非电解质判断,电离方程式书写,明确电解质强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | 在醋酸溶液中加入少量NaHSO4固体,醋酸的电离平衡左移,且溶液中的c(H+)减小 | |
| B. | 将纯水加热到100℃,测得PH<7,说明升高温度可使水呈酸性 | |
| C. | 0.2mol/L的盐酸与水等体积混合,所得溶液的PH=1 | |
| D. | PH=3的稀硫酸与PH=11的氨水等体积混合,所得溶液的PH=7 |
20.下列叙述与图象相对应的是( )
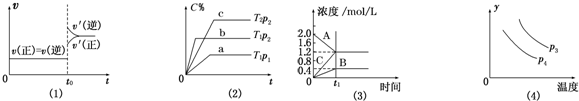

| A. | 图(1)是N2(g)+3H2(g)?2NH3(g)的化学平衡图象,在t0时刻充入一定量的NH3,平衡逆向移动 | |
| B. | 图(3)表示的化学方程式为2A═B+3C | |
| C. | 图(2)中p2>p1,T1>T2 | |
| D. | 图(4)对应反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
7.标准状况下,下列物质占体积最大的是( )
| A. | 98g H2SO4 | B. | 1NA个CO2 | C. | 44.8LHCl | D. | 6gH2 |
4.下列各组选项按照电解质→非电解质→单质→混合物顺序排列的一项是( )
| A. | 盐酸→SO3→石墨→Na2CO3•10H2O | B. | NaCl→NH3→铜→空气 | ||
| C. | 蔗糖→CuSO4→N2→Fe(OH)3胶体 | D. | KCl→CaO→液氯→石灰水 |
 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.