题目内容
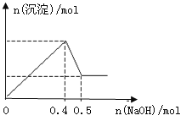
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水中后有1.16g白色沉淀,在所得的悬独液中逐滴加入1mol·L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示。试回答:

(1)A点沉淀物的化学式为_____________,A点熔液中的溶质是___________________;B点沉淀物的化学式为____________________。
(2)原混合物中MgCl2的物质的量为________________,AlCl3的物质的量为__________,NaOH的物质的量为________________。
(3)HCl溶液在Q点的加入量是____________________。
【答案】 Mg(OH)2 NaCl、NaAlO2 Mg(OH)2、Al(OH)3 0.02mol 0.02mol 0.13mol 130mL
【解析】在所得悬浊液中加入加入盐酸,0-A段沉淀的质量没有改变,说明发生反应为:OH-+H+= H2O,可推段NaOH、MgCl2、AlCl3组成的混合物溶于水,反应后,溶液中NaOH过量,此时溶液中Al3+已转化为AlO2-,1.16g白色沉淀应为Mg(OH)2;A-B段,随着盐酸的加入,沉淀的质量开始增加,应发生反应:AlO2-+H++H2O= Al(OH)3↓;B-Q段,沉淀逐渐溶解。
(1)根据上述分析,O点的溶质为:NaOH、NaAlO2,沉淀为Mg(OH)2;A点的溶质为:NaCl、NaAlO2,沉淀为Mg(OH)2;B点溶质为NaCl,沉淀为Mg(OH)2、Al(OH)3;Q点溶质为:NaCl、MgCl2、AlCl3。故答案为:Mg(OH)2;NaCl、NaAlO2;Mg(OH)2、Al(OH)3。
(2)1.16g白色沉淀应为Mg(OH)2,则Mg(OH)2的物质的量为![]() 。根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol;A-B段消耗20mL盐酸,反应为:H2O+AlO2-+H+= Al(OH)3↓,根据n (AlCl3)=n(AlO2-)=n(HCl)=1mol/L×0.02L=0.02mol;B点溶质为NaCl,根据Na原子守恒可知,n(NaOH)=n(NaCl),而Cl-来自于盐酸、MgCl2、AlCl3。O点到B点共加入30mL盐酸,所以n(NaCl)= 1mol/L×0.03L+ n(MgCl2) ×2+ n (AlCl3) ×3=0.13mol,故n(NaOH)=0.13mol;
。根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol;A-B段消耗20mL盐酸,反应为:H2O+AlO2-+H+= Al(OH)3↓,根据n (AlCl3)=n(AlO2-)=n(HCl)=1mol/L×0.02L=0.02mol;B点溶质为NaCl,根据Na原子守恒可知,n(NaOH)=n(NaCl),而Cl-来自于盐酸、MgCl2、AlCl3。O点到B点共加入30mL盐酸,所以n(NaCl)= 1mol/L×0.03L+ n(MgCl2) ×2+ n (AlCl3) ×3=0.13mol,故n(NaOH)=0.13mol;
故答案为:0.02mol;0.02mol;0.13mol;
(3)B-Q段,Mg(OH)2、Al(OH)3逐渐溶解,生成MgCl2、AlCl3,此段消耗HCl物质的量应等于n(MgCl2) ×2+ n (AlCl3)=0.1mol,盐酸浓度为1mol·L-1,则B-Q段消耗盐酸0.1L,即100mL,O-B段共消耗盐酸30mL,HCl溶液在Q点的加入总量为130mL。
故答案为:130mL。