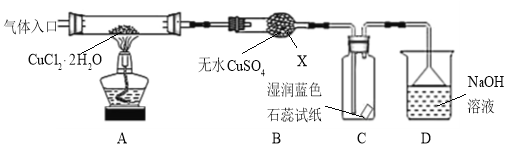
题目内容
【题目】一种离子晶体的晶胞如图其中阳离子A以![]() ,表示阴离子B以
,表示阴离子B以![]() 表示。
表示。
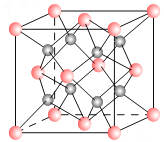
(1)若A和B的核外电子排布与Ar相同,则该离子化合物的化学式是 ___________________;
(2)阳离子周围距离最近的阴离子数为___ __,阴离子周围距离最近的阴离子数___ __。
(3)若与MgO的熔点比较,出现不同的原因是
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。
【答案】(1)CaCl2;(2)8,4;(3)Mg2+比O2-的半径小,O2-的电荷多,MgO的晶格能大,更稳定,故MgO熔点更高;(4)![]() r3。
r3。
【解析】
试题分析:(1)根据均摊的方法,阳离子的个数为8×1/8+6×1/2=4,阴离子位于体心,阴离子的个数为8,则化学式为AB2,因为核外电子排布与Ar相同,A位于第四周期,B位于第三周期,因此化学式为CaCl2;(2)根据晶胞图,阳离子周围距离最近的阴离子数为8,阴离子周围最近的阴离子数4;(3)MgO、CaCl2属于离子化合物,离子化合物熔沸点与晶格能有关,晶格能越大,熔沸点越高,影响晶格能是半径和所带电荷数,半径越小,所带电荷数越多,晶格能越大,Mg2+比O2-的半径小,O2-的电荷多,MgO的晶格能大,更稳定,故MgO熔点更高;(4)该晶胞中正方形对角线的长度=4rm,则该晶胞的边长为![]() ,则该晶胞的体积为
,则该晶胞的体积为![]() r3。
r3。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目