题目内容
【题目】[化学—选修2:化学与技术]
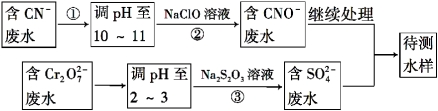
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾。某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)过滤操作中用到的玻璃仪器有___________。
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是____________。
(3)滤渣a的主要成分是_________________。
(4)步骤③中X的取值范围是____________________。
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。共消耗14.00mLNa2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为____________。
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是______________。
(6)请你设计一个由滤渣c得到Al2(SO4)3·18H2O的实验方案___________。
【答案】(1)漏斗、烧杯、玻璃棒;
(2)Cu+H2O2+2H+=Cu2++2H2O;(3)Au;
(4)5.2≤X<5.4;(5)①87.5%;②样品中的杂质Na2SO4中也含有SO42-;
(6)将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到晶体
【解析】
试题分析:由流程可知,金属混合物加入稀硫酸铝、铁溶解,加入过氧化氢,亚铁离子被氧化为铁离子,铜在酸性溶液中被过氧化氢氧化为铜离子,过滤得到滤渣a为Au,滤液中主要含有铁离子、铝离子和铜离子,加入氢氧化钠溶液调节溶液pH=3.4,依据题干信息,是为了沉淀铁离子,过滤得到滤渣b为Fe(OH)3,滤液为铝离子和铜离子,加入氢氧化钠溶液调节溶液pH=5.2~5.4使铝离子全部沉淀过滤得到滤渣C为Al(OH)3,用硫酸溶解后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)218H2O晶体;得到滤液为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)过滤是化学实验中经常用到的实验操作.过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)Cu可溶于稀硫酸与H2O2的混合溶液,铜被氧化成铜离子,双氧水生成水,根据化合价升降相等配平,反应的离子方程式是Cu+H2O2+2H+=Cu2++2H2O;
(3)由于Cu、Al、Fe都因反应溶解于溶液中,剩下Au不反应,过滤到了滤渣a中;
(4)加入氢氧化钠溶液调节pH=x,目的是生成氢氧化铝沉淀,氢氧化铝开始沉淀pH=4,沉淀完全pH=5.2,氢氧化铜开始沉淀pH=5.4,所以选择的pH范围是:5.2≤X<5.4;
(5)由2Cu2++4I-=2CuI(白色)↓+I2、2S2O32-+I2=2I-+S4O62-可知, 反应的定量关系为:
2Cu2+~I2 ~2S2O32-
1.4×10-3mol 0.100 0molL-1×0.014.00L=1.4×10-3mol
100ml溶液中含硫酸铜晶体物质的量为1.4×10-2mol,所以硫酸铜晶体的质量分数 = ![]() × 100% = 87.5%;
× 100% = 87.5%;
②依据流程分析判断,样品中含有硫酸钠,不能通过测定硫酸根离子的方法计算得到硫酸铜晶体的质量分数;
(6)分析流程可知,滤渣C主要是氢氧铝,加入硫酸溶解后通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体Al2(SO4)318H2O。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下表是元素周期表一部分,列出了十个元素在周期表中的位置:
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | |||||||
3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
4 | ② | ④ | ⑨ |
请用化学用语回答下列问题
(1)在①~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),⑤所对应元素的单质工业制备方法为 。
(3)用电子式表示元素③与⑧形成化合物的过程 。
(4)我国首创以单质⑤—空气—海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极反应是 ,正极反应为 。