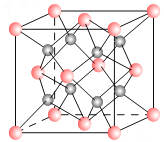
题目内容
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
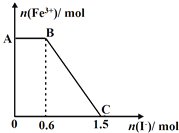
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.25mol
D.K2Cr2O7可与FeSO4反应的物质的量为1:3
【答案】D
【解析】
试题分析:A.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故A正确;B.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故B正确;C.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为![]() mol=0.25mol,故C正确;D.由方程式2Fe3++2I-→2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误;故选D。
mol=0.25mol,故C正确;D.由方程式2Fe3++2I-→2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误;故选D。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】一种高分子化合物(VI)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
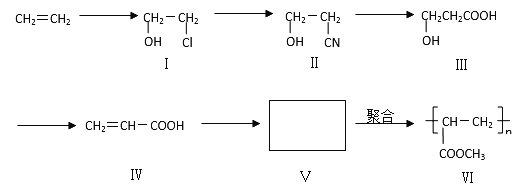
回答下列问题:
(1)目前工业上生产乙烯主要是以 为原料通过 反应来实现。
(2)化合物III生成化合物IV的另外一种产物是 。(提示:该反应的逆反应原子利用率为100%)
(3)写出合成路线中从化合物IV到化合物VI的两步反应的化学方程式: 、 。
(4)下列关于化合物III、IV和V的说法中,正确的是 (填字母)
A.化合物III可以发生氧化反应 |
B.化合物III不可以与NaOH 溶液反应 |
C.化合物IV能与氢气发生加成反应 |
D.化合物III、IV和V均可与金属钠反应生成氢气 |
E.化合物IV和V均可以使溴的四氯化碳溶液褪色