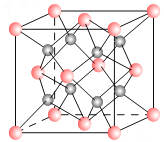
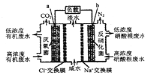
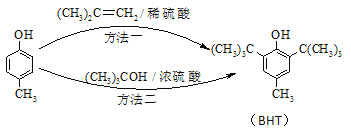
题目内容
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10 mol/L CH3COOH溶液中值增大的措施是___________。
a.加水稀释
b.加入少量CH3COONa固体
c.加入少量冰醋酸
d.通入少量HCl气体
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b= 。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因 ;该混合溶液中:c(A-)-c(Na+)= mol/L。(填准确数值)
(3)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。
①三种溶液pH由大到小的顺序为: (填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3) c(CO32-) (填“>”、“<”或“=”)。
(4)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 。 (填写序号);b中氯离子的浓度为 mol/L。
【答案】(16分)(1)(1)ad;
(2)①14;②HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液的pH=5;9.9×10-6或者10-5-10-7
(3)①b>a>c ②> (4)b>a>d>c 9×10-10
【解析】
试题分析:(1)a.加水稀释醋酸促进醋酸电离,且氢离子浓度减小,所以能使c(H+)/c(CH3COOH)值、pH均增大,故a正确;b.加CH3COONa,由于CH3COO-对CH3COOH的电离起到抑制作用,则c(H+)/c(CH3COOH)值减小,故b错误;c.加少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,则c(H+)/c(CH3COOH)值减小,故c错误;d.通入HCl气体,溶液里c(H+)明显增大,平衡逆向移动,c(CH3COOH)略有增大,但c(H+)/c(CH3COOH)值增大,故d正确;故选ad;
(2)①若100体积pH=a的硫酸溶液中氢离子的物质的量浓度=10-a mol/L,1体积pH=b的NaOH溶液中氢氧根离子的物质的量浓度=10 b-12 mol/L,混合后溶液呈中性,则氢离子的物质的量等于氢氧根离子的物质的量,所以100×10-a mol/L=1×10 b-12 mol/L,所以a+b=14;
②pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果酸是强酸,则盐溶液呈中性,实际上溶液呈酸性,则HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液的pH=5;该溶液中存在电荷守恒式为c(A-)+c(OH-)=c(Na+)+c(H+),则c(A-)-c(Na+)=c(H+)-c(OH-)=(10-5-10-7)mol/L=9.9×10-6mol/L。
(3)已知酸性的强弱顺序为:CH3COOH>H2CO3>HClO;①酸性越弱水解程度越强,浓度相等时溶液的碱性越强,三种溶液pH由大到小的顺序为b>a>c;②NaHCO3溶液的pH大于8,HCO3-的水解程度大于其电离程度,则溶液中c(H2CO3)>c(CO32-);
(4)①a.100mL 0.2molL-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,c.100mL 0.1molL-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;d.100mL 0.1molL-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为b>a>d>c;b.100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,加如氯化银后,氯离子浓度为![]() =9×10-10mol/L。
=9×10-10mol/L。

 培优口算题卡系列答案
培优口算题卡系列答案