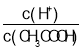题目内容
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,这四种元素仅处于两个周期,其中X元素的最外层电子数是其层数的3倍,这四种元素构成的一种离子化合物的结构如图所示。下列说法正确的是( )
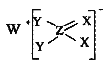
A.原子半径Y>Z>X
B.单质W在其同族元素形成的单质中熔点最低
C.Z的最高价氧化物对应的水化物是中强酸
D.该化合物中的所有元素均满足8电子稳定结构
【答案】C
【解析】
X元素的最外层电子数是其层数的3倍,则X的电子层结构为2,6,为O元素;四种元素仅处于两个周期,所以W一定位于第二周期,Z一定位于第三周期;W可以形成+1价阳离子,所以为第IA族元素,原子序数小于O,则为Li元素;Z可以形成5个共价键,应为第ⅤA族元素,处于第三周期,则为P元素,Y可以形成一个共价键,应为F元素。
A.电子层数越多原子半径越大,电子层数相同,核电荷数越小半径越多,所以原子半径P>O>F,即Z>Y>X,故A错误;
B.Li为第IA族元素,其同族元素H元素的单质常温下为气态,熔点最低,故B错误;
C.P元素的最高价氧化物的水化物为H3PO4,为中强酸,故C正确;
D.该化合物中P元素最外层电子数为10,故D错误;
故答案为C。

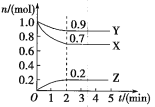
【题目】在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
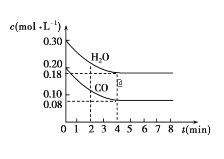
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=___mol/(L·min),v(H2)=___mol/(L·min),v(CO2)=___mol/(L·min)。
(2)请你在图中标出CO2和H2的浓度变化。___
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
CO | 0.200 | 0.138 | c1 | c1 | 0.116 | 0.096 |
H2O | 0.300 | 0.238 | c2 | c2 | 0.216 | 0.266 |
CO2 | 0 | 0.062 | c3 | c3 | 0.084 | 0.104 |
H2 | 0 | 0.062 | c4 | c4 |
①表中3min~4min之间,反应处于___状态;c1___0.08mol/L(填“大于”、“小于”或“等于”)。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是___(单选),表中5min~6min之间数值发生变化,可能的原因是___(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度