题目内容
(9分)、铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)、配平下列化学方程式(并解答对应问题):
KMnO4+ HCl== KCl+ MnCl2+ Cl2↑+ H2O
氧化剂 还原剂
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)、配平下列化学方程式(并解答对应问题):
KMnO4+ HCl== KCl+ MnCl2+ Cl2↑+ H2O
氧化剂 还原剂
(9分)(1)32
(2)2Fe3++Cu=2Fe2++Cu2+ Fe(其他合理答案也给分)
(3)2、16、2、2、5、8 KMnO4 HCl
(2)2Fe3++Cu=2Fe2++Cu2+ Fe(其他合理答案也给分)
(3)2、16、2、2、5、8 KMnO4 HCl
(1)在反应中氧气是氧化剂,所以转移电子的物质的量是8×4=32mol。
(2)氯化铁和铜单质反应的方程式是2Fe3++Cu=2Fe2++Cu2+。要得到金属铜,则还需要加入还原剂铁。
(3)根据方程式可知,高锰酸钾中锰元素的化合价从+7价降低到+2价,得到5个电子,作氧化剂;氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,作还原剂。所以根据电子的得失守恒可知,配平后的计量数依次是2、16、2、2、5、8。
(2)氯化铁和铜单质反应的方程式是2Fe3++Cu=2Fe2++Cu2+。要得到金属铜,则还需要加入还原剂铁。
(3)根据方程式可知,高锰酸钾中锰元素的化合价从+7价降低到+2价,得到5个电子,作氧化剂;氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,作还原剂。所以根据电子的得失守恒可知,配平后的计量数依次是2、16、2、2、5、8。

练习册系列答案
相关题目
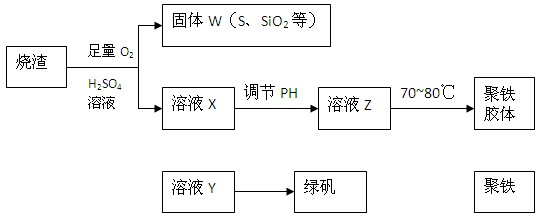
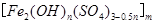 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下: