题目内容
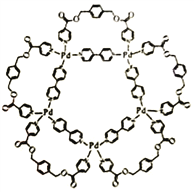
【题目】一种可用于生物医学领域的平面五角星形钯(Ⅱ)配位络离子结构如右图,已知钯是原子序数为46的过渡元素。
回答下列问题。
(1)钯(Ⅱ)配位络离子中的第二周期元素,其第一电离能从大到小的顺序为_____________(填元素符号)。
(2)钯(Ⅱ)配位络离子中含有的作用力类型为___________ (填序号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(3)钯(Ⅱ)配位络离子中基态钯离子价电子排布式为____________,钯离子的杂化轨道类型_______(填“是”或“不是”)sp3,理由是___________。
(4)钯(Ⅱ)配位络离子中能与氢氧化钠溶液反应的配体,其分子式为__________,每1mol该配体与氢氧化钠反应时断裂的共价键类型及数目为____________。
(5)钯易与亚砜(![]() )生成配合物。当R1和R2都为-CH2C6H5时,三种配合物的结构和键长数据如下:
)生成配合物。当R1和R2都为-CH2C6H5时,三种配合物的结构和键长数据如下:
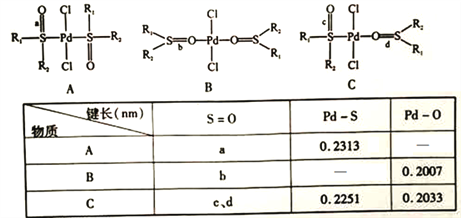
①亚砜的晶体类型为___________________。
②配位键稳定性:Pd-s>Pd-O,其证据为______________ (用上表数据说明)。
③三种配合物中S=O键长不同,其数值最小的是______________(填“a"“b"“c”或“d")
【答案】 N>O>C C、D 4d8 不是 若SP3杂化类型 ,空间构型应为四面体型,不可能形成五角星形(钯离子还有4d空轨道) C20H16N2O4 δ键或极性键 2NA 分子晶体 Pd-S键长A中为0.2313nm;Pd-O键长B中为0.2007nm,B中为0.2033nm C
【解析】(1)钯(Ⅱ)配位络离子中的第二周期元素,C、N、O处于同一周期,从左到右第一电离能有变大的趋势,N的2p能级处于半充满状态,其第一电离能变大,故第一电离能从大到小的顺序为N>O>C;(2)钯(Ⅱ)配位络离子中含有的作用力类型为 C.共价键:C-N键等 、D.配位键:Pd-N键;没有以下类型的键:A.金属键,只存在于金属原子间;B.离子键:存在于阴阳离子间; E.氢键:存在于电负性较大的原子与H原子间; F.范德华力:存在于分子间;故选CD。(3)钯(Ⅱ)配位络离子中基态钯离子价电子排布式为4d8,钯离子的杂化轨道类型不是sp3,理由是 若SP3杂化类型 ,空间构型应为四面体型,不可能形成五角星形(钯离子还有4d空轨道)。(4)钯(Ⅱ)配位络离子中能与氢氧化钠溶液反应的配体含有酯基,其分子式为C20H16N2O4,每1mol该配体与氢氧化钠反应时C-O键断裂,共价键类型为δ键或极性键,数目为 2NA ;(5)钯易与亚砜(![]() )生成配合物。①亚砜由分子构成,晶体类型为分子晶体。②配位键稳定性:Pd-s>Pd-O,其证据为Pd-S键长A中为0.2313nm;Pd-O键长B中为0.2007nm,B中为0.2033nm ,键长越短越稳定。③b中O电子提供给Pd,S=O键长最长,A、C对比,如图
)生成配合物。①亚砜由分子构成,晶体类型为分子晶体。②配位键稳定性:Pd-s>Pd-O,其证据为Pd-S键长A中为0.2313nm;Pd-O键长B中为0.2007nm,B中为0.2033nm ,键长越短越稳定。③b中O电子提供给Pd,S=O键长最长,A、C对比,如图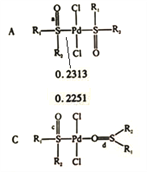 C中O吸改Pd电子,增大Pd下S之间作用,c的S=O键长最短,三种配合物中S=O键长不同,其数值最小的是c。
C中O吸改Pd电子,增大Pd下S之间作用,c的S=O键长最短,三种配合物中S=O键长不同,其数值最小的是c。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案