题目内容
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
 .
.
(3)最高价氧化是两性氧化物的元素是
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于
,该化合物属于
(5)表示①与⑦的化合物的电子式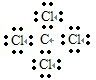
 ,该化合物是由
,该化合物是由
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
Ar
Ar
(填具体元素符号,下同).(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
HClO4
HClO4
,碱性最强的化合物的电子式是:

(3)最高价氧化是两性氧化物的元素是
Al
Al
;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(4)用电子式表示元素④与⑥的化合物的形成过程:


离子
离子
(填“共价”或“离子”)化合物.(5)表示①与⑦的化合物的电子式


极性共价键
极性共价键
(填“极性”“非极性”下同)键形成的.分析:根据元素在周期表的位置先推断出元素①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K.
(1)稀有气体元素的化学性质最不活泼;
(2)根据元素周期表中最高价氧化物对应水化物的酸性和碱性的地变规律来回答;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,生成盐和水;
(4)硫化钠是钠离子和硫离子之间通过离子键形成的离子化合物;
(5)根据四氯化碳的成键元素和成键形式来书写电子式并确定化学键的类型.
(1)稀有气体元素的化学性质最不活泼;
(2)根据元素周期表中最高价氧化物对应水化物的酸性和碱性的地变规律来回答;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,生成盐和水;
(4)硫化钠是钠离子和硫离子之间通过离子键形成的离子化合物;
(5)根据四氯化碳的成键元素和成键形式来书写电子式并确定化学键的类型.
解答:解:根据元素在周期表的位置先推断出元素①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K.
(1)稀有气体元素的化学性质最不活泼,故答案为:Ar;
(2)周期表中从左到右元素最高价氧化物对应水化物的酸的酸性逐渐增强,碱性逐渐减弱,从上到下元素最高价氧化物对应水化物的酸的酸性逐渐减弱,碱性逐渐增强,所以酸性最强的是高氯酸,碱性最强的是氢氧化钾,故答案为:HClO4; ;
;
(3)氧化铝是两性氧化物,能和强碱反应生成盐和水,氧化铝和强碱反应的实质是:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)硫化钠为离子化合物,离子和原子都满足8电子稳定结构,离子键形成过程为: ,
,
故答案为: ;
;
(5)四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为: ,该化合物中碳原子和氯原子之间的化学键是极性共价键,
,该化合物中碳原子和氯原子之间的化学键是极性共价键,
故答案为: ;极性共价键.
;极性共价键.
(1)稀有气体元素的化学性质最不活泼,故答案为:Ar;
(2)周期表中从左到右元素最高价氧化物对应水化物的酸的酸性逐渐增强,碱性逐渐减弱,从上到下元素最高价氧化物对应水化物的酸的酸性逐渐减弱,碱性逐渐增强,所以酸性最强的是高氯酸,碱性最强的是氢氧化钾,故答案为:HClO4;
 ;
;(3)氧化铝是两性氧化物,能和强碱反应生成盐和水,氧化铝和强碱反应的实质是:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)硫化钠为离子化合物,离子和原子都满足8电子稳定结构,离子键形成过程为:
 ,
,故答案为:
 ;
;(5)四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为:
 ,该化合物中碳原子和氯原子之间的化学键是极性共价键,
,该化合物中碳原子和氯原子之间的化学键是极性共价键,故答案为:
 ;极性共价键.
;极性共价键.点评:本题考查学生对元素周期表的结构、元素周期律以及化学中化学用语的掌握程度,可以根据所学知识进行回答.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是