题目内容
8.现有如下两个反应:(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池
(A)能; (B)不能;(填“能”与“不能”)
(2)根据能设计成原电池的反应选择适宜的材料和试剂设计一个原电池:
①负极材料是Cu; 电解质溶液是FeCl3溶液.(填化学式)
②写出电极反应式:负极Cu-2e-=Cu2+;正极2Fe3++2e-=2Fe2+.
③若导线上转移电子1mol,则负极质量变化32g.
分析 (1)原电池反应是自发进行的放热的氧化还原反应;
(2)根据电池反应式知,失电子化合价升高的金属单质作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液为原电池电解质溶液;
根据转移电子和Cu之间的关系式计算消耗Cu的质量.
解答 解:(1)原电池反应是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,所以不是氧化还原反应,不能设计成原电池,(B)中Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以(B)能设计成原电池,
故答案为:能;不能;
(2)①根据电池反应式知,失电子化合价升高的金属单质作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液为原电池电解质溶液,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极、FeCl3溶液作电解质溶液,
故答案为:Cu;FeCl3溶液;
②负极上Cu失电子发生氧化反应、正极上铁离子得电子发生还原反应,所以负极、正极反应式分别为Cu-2e-=Cu2+、2Fe3++2e-=2Fe2+,故答案为:
Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+;
③根据负极反应式Cu-2e-=Cu2+得消耗m(Cu)=$\frac{1mol}{2mol}×64g/mol$=32g,
故答案为:32.
点评 本题考查原电池设计,明确原电池原理及原电池反应特点是解本题关键,侧重考查学生知识运用能力,难点是判断正负极及电解质溶液,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
18.从甜橙的芳香油中可分离得到如下结构的化合物: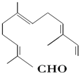 现有试剂:
现有试剂:
①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
 现有试剂:
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦的化合物的电子式 ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.
16.在光照下,将等物质的量的CH4和Cl2充分反应,得到产物的物质的量最多的是( )
| A. | HCl | B. | CH3Cl | C. | CHCl3 | D. | CCl4 |
3. 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | C(HCL)(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-1-2 | B. | 1-2-4-3 | C. | 4-2-3-1 | D. | 4-3-2-1 |
13.有机物分子中,若有1个碳原子用4个单键与4个互不相同的原子或原子团相连,这样的碳原子称为“手性碳”.若烯烃 分子中含有手性碳,该烯烃的一个分子中至少含有的碳原子数是( )
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
20.已知酸性强弱顺序为H2CO3>C6H5OH>HCO3-,下列化学方程式正确的是( )
| A. | 2 C6H5ONa+H2O+CO2→2 C6H5OH+Na2CO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| C. | C6H5OH+Na2CO3→C6H5ONa+NaHCO3 | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
 ;
; 如图是实验室制备SO2并验证SO2某些性质的装置图.
如图是实验室制备SO2并验证SO2某些性质的装置图.