题目内容
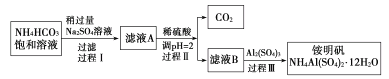
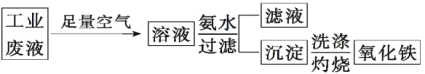
【题目】I.氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种酸性工业废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁的流程如图所示:
已知:常温下Ksp[Mg(OH)2]=1.2×10-11、Ksp[Fe(OH)2]=2.2×10-16、Ksp[Fe(OH)3]=3.5×10-38、Ksp[Al(OH)3]=1.0×10-33。
(1)写出在该酸性废液中通入空气时发生的反应的离子方程式:_________________,使用空气的优点是_____。
(2)常温下,在pH=5的溶液中Fe3+存在的最大浓度为_____。
(3)有人利用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
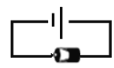
II.某研究性学习小组为探究Fe3+与Ag反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。
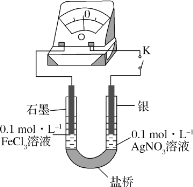
(4)K闭合时,指针向左偏转,石墨作____(填“正极”或“负极”)。
(5)当指针归零后,向左侧U形管中滴加几滴FeCl2浓溶液,发现指针向右偏转,写出此时银电极的反应式:_____。
(6)结合上述实验分析,写出Fe3+和Ag反应的离子方程式:____。
【答案】4Fe2++O2+4H+=4Fe3++2H2O 耗费少且无污染 3.5×10 -11 mol·L -1 Al(OH)3 NaOH 正极 Ag++e-==Ag Ag+Fe3+ ![]() Ag++Fe2+
Ag++Fe2+
【解析】
I.某种酸性工业废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中通入足量的空气,Fe2+被氧化为Fe3+;加入氨水,Fe3+、Al3+、Mg2+都会转化为沉淀,所以要想获得比较纯净的氧化铁,加入氨水时,需控制溶液的pH,只允许Fe3+生成Fe(OH)3沉淀。
II.在此盐析溶液中,Fe3+只能得电子,则Ag失电子,从而形成原电池;若U形管的左侧溶液中含有还原性离子,则右侧溶液中的Ag+也可以获得电子生成Ag。
(1)在该酸性废液中通入空气,Fe2+被O2氧化为Fe3+,发生的反应的离子方程式:4Fe2++O2+4H+=4Fe3++2H2O,使用空气,不需增加成本,不需考虑污染,其优点是耗费少且无污染。答案为:4Fe2++O2+4H+=4Fe3++2H2O;耗费少且无污染;
(2)常温下,在pH=5的溶液中,c(OH-)=10-9mol/L,Fe3+的最大浓度为![]() mol·L -1=3.5×10 -11 mol·L -1。答案为:3.5×10 -11 mol·L -1;
mol·L -1=3.5×10 -11 mol·L -1。答案为:3.5×10 -11 mol·L -1;
(3)在pH=5时将Fe(OH)3沉淀出来,此时c(Al3+)=![]() =1.0×10-6mol/L,则Al3+完全沉淀,此时可能混有的杂质是Al(OH)3,可用NaOH溶液将其除去。答案为:Al(OH)3;NaOH;
=1.0×10-6mol/L,则Al3+完全沉淀,此时可能混有的杂质是Al(OH)3,可用NaOH溶液将其除去。答案为:Al(OH)3;NaOH;
(4)K闭合时,指针向左偏转,则电子由右往左迁移,石墨作正极。答案为:正极;
(5)指针向右偏转,则表明左侧(石墨电极)为负极,右侧(银电极)为正极,此时银电极的反应式:Ag++e-==Ag。答案为:Ag++e-==Ag;
(6)结合上述实验分析,Fe3+和Ag的反应是一个可逆反应,反应的离子方程式为Ag+Fe3+ ![]() Ag++Fe2+。答案为:Ag+Fe3+
Ag++Fe2+。答案为:Ag+Fe3+ ![]() Ag++Fe2+。
Ag++Fe2+。

【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为_________________________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________________________________________。
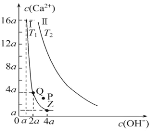
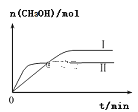
(3)①CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为______________________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是______________。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
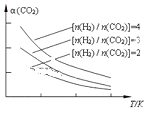
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
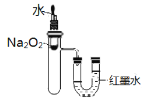
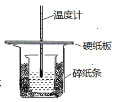
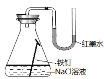
实验一:用下图所示装置进行实验。
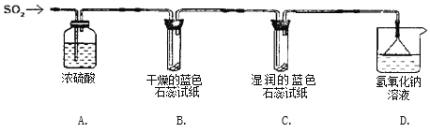
(1)A装置的作用是_________(填“干燥”或“氧化”)SO2气体。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变_______色(填“蓝色”或“红色”或“不变色”),说明SO2与水反应生成一种酸。
(3)D装置的作用是______________,并写出化学反应方程式_____________________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_________(填“催化剂”或“氧化剂”)。
(探究结论)SO2与空气中的氧气、水反应生成硫酸形成酸雨。该市可能易出现酸雨(知识联想)
(1)酸雨造成的危害是:______________________________(举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。