题目内容
【题目】A、B、C、D、E五种元素位于元素周期表的前四周期,其核电荷数依次增大。A的阴离子与He具有相同的电子层结构,B原子的核外有三对自旋方向相反的电子,C原子的核外有两个未成对电子,D与B同主族,E原子与A原子的最外层电子数相同,且内层充满电子。
(1)A原子的电子所处的原子轨道的形状为_______。
(2)B原子的核外电子排布式为_______, B元素位于元素周期表的_______区。
(3)M是由B、D原子组成的一种具有漂白性的分子,M分子的空间构型为_______,N是由B、D原子构成的一种阴离子,D呈现最高价,则D原子的杂化方式为_______。写出一种N的等电子体的化学式_______。
(4)B与C形成的一种无限长单链结构如下图所示,该结构中B与C的原子数之比为_______。

(5)E位于元素周期表第_______族。已知单质E的晶体为面心立方最密堆积,E的原子半径为anm,其晶胞的平面切面图如右图所示。列式表示E晶胞中原子的空间利用率_______(空间利用率等于晶胞中原子的体积占晶胞体积的百分比。注意:只写数值不得分)。

【答案】 球形 1s22s22p4 p V形或折线形 sp3 ClO4-、PO43-、CCl4等 3:1 IB 
【解析】A、B、C、D、E五种元素位于元素周期表的前四周期,其核电荷数依次增大。A的阴离子与He具有相同的电子层结构,则A为氢元素;B原子的核外有三对自旋方向相反的电子,则B为氧元素,D与B同主族,则D为硫元素;C原子的核外有两个未成对电子,则C为硅元素;E原子与A原子的最外层电子数相同,且内层充满电子,则E的核电荷数为29,E为铜元素;
(1)A原子的电子所处的原子轨道为1s,其形状为球形;
(2)基态氧原子的核外电子排布式为1s22s22p4, B元素位于元素周期表的第二周期ⅥA族,属于p区元素;
(3)由O、S原子组成的一种具有漂白性的分子是SO2,SO2分子的中心原子S原子的杂化轨道数为![]() =3,采取sp2杂化,含有1对孤对电子对,故SO2为V型结构;S的最高价为+6价,则N是SO42-,SO42-中S形成4个σ键,孤对电子数为
=3,采取sp2杂化,含有1对孤对电子对,故SO2为V型结构;S的最高价为+6价,则N是SO42-,SO42-中S形成4个σ键,孤对电子数为![]() =0,为sp3杂化;与SO42-等电子体的微粒有ClO4-、PO43-、CCl4等;
=0,为sp3杂化;与SO42-等电子体的微粒有ClO4-、PO43-、CCl4等;
(4)O与Si形成的一种无限长单链结构如下图所示,氧原子数为2+2×![]() =3、Si原子数为1,则该结构中B与C的原子数之比为3:1;
=3、Si原子数为1,则该结构中B与C的原子数之比为3:1;
(5)Cu元素核电荷数为29,其位于元素周期表第四周期第IB族。Cu的原子半径为anm,晶胞的边长为2 ![]() nm,Cu原子的体积为
nm,Cu原子的体积为![]() ,晶胞的体积为(2
,晶胞的体积为(2 ![]() nm)3;晶胞中含有Cu原子数为8×
nm)3;晶胞中含有Cu原子数为8×![]() +6×
+6×![]() =4,则Cu晶胞中原子的空间利用率为
=4,则Cu晶胞中原子的空间利用率为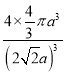 。
。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案