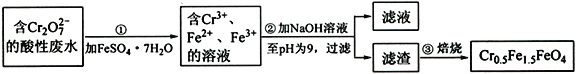
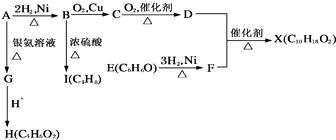
题目内容
【题目】原电池是将化学能转变为电能的装置。关于下图所示原电池的说法不正确的是
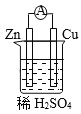
A. Cu为正极,Zn为负极 B. 电子由铜片通过导线流向锌片
C. 正极反应式为2H+ + 2e- ![]() H2↑ D. 原电池的反应本质是氧化还原反应
H2↑ D. 原电池的反应本质是氧化还原反应
【答案】B
【解析】原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此判断。
A. 金属性Zn>Cu,因此Cu为正极,Zn为负极,A正确;
B. Cu为正极,Zn为负极,电子由锌片通过导线流向铜片,B错误;
C. 氢离子在正极放电,正极反应式为2H+ +2e-=H2↑,C正确;
D. 原电池的反应本质是氧化还原反应,D正确。答案选B。

【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
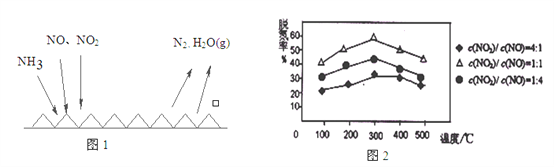
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
【题目】H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1molL﹣1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式: .
②设计实验方案:在不同H2O2浓度下,测定(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
物理量 | 0.1molL﹣1Fe2(SO4)3 | 30% H2O2 | H2O |
1 | 0.5 | 15 | |
2 | 0.5 | 30 | 9.5 |
④查阅资料,30%的H2O2的密度为1.13g/mL,若实验测得实验2中H2O2全部分解所需的时间为2min,则用H2O2表示该反应在2min内的平均速率为(设溶液体积变化忽略不计)
(2)利用图2﹣(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),其原因是 
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
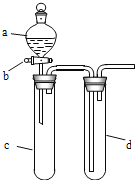
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是_______________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是__________________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是________,c中加入的试剂是________,d中加入的试剂是________;实验现象为________________。