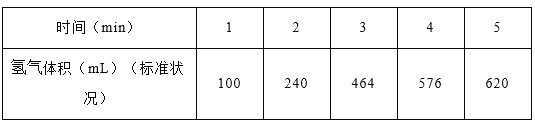
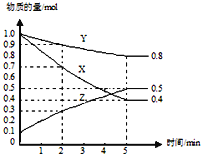
题目内容
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。某厂为了变废为宝,将工业废水(含5.00×10-3 mol·L-1的Cr2O72-)处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验流程:
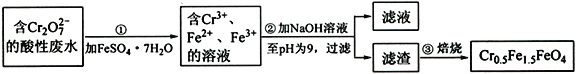
(1)第①步反应的离子方程式是________________________________。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有____________________。
(3)为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe2+与Fe3+的比例为______________。在第②步过程中,须持续通入N2,原因是________________________________。
(4)将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是________________________________。
(5)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备FeCl3·6H2O,请设计制取FeCl3·6H2O的实验步骤:___________________________。 (可选用的试剂:铁粉、盐酸和H2O2溶液)
【答案】 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O Fe(OH)3和Fe(OH)2 2:3 N2气氛下,防止Fe2+被氧化 4FeCO3+6H2O+O2=4Fe(OH)3+4CO2 向废液中加入足量铁粉,充分反应后过滤;在滤渣中加入足量盐酸,充分反应后过滤;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+;将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3·6H2O
【解析】(1)第①步反应是含Cr2O72-的酸性废水与绿矾反应,Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(2)含Cr3+、Fe2+、Fe3+的溶液与氢氧化钠反应生成Cr(OH)3、Fe(OH)3、Fe(OH)2,故第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有Fe(OH)3和Fe(OH)2;(3)根据磁性材料Cr0.5Fe1.5FeO4分子组成可知,Fe2+与Fe3+的比例为x:y,则根据化合物各元素化合价代数和为0得:x+y=2.5,0.5×3+2x+3y-2×4=0,解得x=1,y=1.5,故为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe2+与Fe3+的比例为1:1.5=2:3;在第②步过程中,须持续通入N2,原因是N2气氛下,防止Fe2+被氧化;(4)含FeCO3的浊液长时间暴露在空气中,会有部分固体表面变为红褐色Fe(OH)3,反应的化学方程式为:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2;(5)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备FeCl3·6H2O,必须除去铜离子,将亚铁离子氧化为铁离子,再转化为沉淀,故制取FeCl3·6H2O的实验步骤为:向废液中加入足量铁粉,充分反应后过滤;在滤渣中加入足量盐酸,充分反应后过滤;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+;将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3·6H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为__________。
(2)⑨在元素周期表中的位置是_______________________________。
(3)用电子式表示④与⑦的原子形成化合物的过程:_________________________________。
(4)可以用来验证④⑤两种元素金属性强弱的实验是__________(填字母代号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同的这两种元素的单质分别和温度相同的热水作用,并滴入酚酞
d.比较这两种元素的氢化物的稳定性
(5)⑥⑦两种元素的简单阴离子还原性较强的是________(填离子符号);用一个置换反应证实这一结论__________________________(填化学方程式)。