题目内容
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
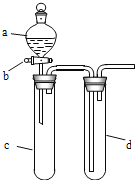
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是_______________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是__________________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是________,c中加入的试剂是________,d中加入的试剂是________;实验现象为________________。
【答案】 检查装置气密性 Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 丙 稀盐酸 大理石(或Na2CO3固体) Na2SiO3溶液 c中有气泡产生,d中生成白色胶状物质(或白色沉淀)
【解析】分析:(1)实验前要检查装置气密性;
(2)浓硝酸和铜反应生成硝酸铜、二氧化氮和水;
(3)根据反应中是否产生污染性气体以及反应物利用率是否达到100%分析;
(4)根据强酸制备弱酸的原理分析。
详解:(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是检查装置的气密性;
(2)浓硝酸和铜反应生成硝酸铜、二氧化氮和水,反应的化学方程式为. Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)方案甲是铜和浓硝酸反应生成硝酸铜,二氧化氮和水,有污染气体生成,不能体现绿色化学理念;方案乙是稀硝酸和铜反应生成硝酸铜,一氧化氮和水,有污染气体生成,不能体现绿色化学理念;丙是利用铜和氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜,反应过程中无污染气体生成,能体现绿色化学理念,答案选丙;
(4)要证明酸性强弱,应该采用强酸制取弱酸的方法检验,盐酸酸性最强,所以a中盛放盐酸,盐酸和碳酸钙或碳酸钠反应制取二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸沉淀,则c中盛放碳酸钙或碳酸钠、d中盛放硅酸钠,硅酸难溶于水,所以二氧化碳和硅酸钠反应生成硅酸沉淀,看到的现象是c中有气泡产生,d中生成白色胶状物质。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案