题目内容
甲醇是一种非常好的燃料.熔点-97.8°C,沸点64.5°C.一定条件下,CO与H2反应可制得甲醇:CO+2H2 CH3OH
CH3OH
图1表示该反应进行过程中的能量变化;图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.
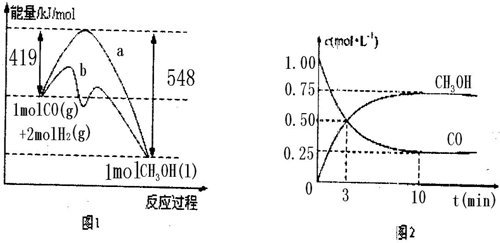
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,写出表示CH3OH燃烧热的热化学方程式
(2)根据上图2计算:该温度下,反应CO(g)+2H2(g) CH3OH(g)△H<0的平衡常数为
CH3OH(g)△H<0的平衡常数为
倍;改变下列条件,能提高CO转化率的是
A.降低温度B.加催化剂
C.充入氩气,使体系压强增大D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压.
 CH3OH
CH3OH图1表示该反应进行过程中的能量变化;图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.

(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,写出表示CH3OH燃烧热的热化学方程式
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=-725.6mol/L
| 3 |
| 2 |
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=-725.6mol/L
.| 3 |
| 2 |
(2)根据上图2计算:该温度下,反应CO(g)+2H2(g)
 CH3OH(g)△H<0的平衡常数为
CH3OH(g)△H<0的平衡常数为12(mol/L)-2
12(mol/L)-2
;10min后,容器内的压强变为原来的| 1 |
| 2 |
| 1 |
| 2 |
ADE
ADE
.A.降低温度B.加催化剂
C.充入氩气,使体系压强增大D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压.
分析:(1)利用盖斯定律计算;
(2)计算出平衡时各物质的平衡浓度,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可求得平衡常数,根据阿伏加德罗定律可知压强之比等于物质的量之比,使平衡向正反应方向移动有利于提高CO转化率.
(2)计算出平衡时各物质的平衡浓度,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可求得平衡常数,根据阿伏加德罗定律可知压强之比等于物质的量之比,使平衡向正反应方向移动有利于提高CO转化率.
解答:解:(1)CO的燃烧热为283kJ/mol,则CO的与氧气反应的热化学方程式为
CO(g)+
O2(g)═CO2(g);△H=-283kJ/mol①
H2的燃烧热为285.8kJ/mol,则H2与氧气反应的热化学方程式为H2(g)+
O2(g)═H2O(l);△H=-285.8kJ/mol②
由图1可知,CO与H2反应可制得甲醇的热化学方程式为:CO(g)+2H2(g)═CH3OH(l);△H=-129kJ/mol③
根据盖斯定律,则CH3OH燃烧热的热化学方程式由①+②×2-③可得:
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=-725.6mol/L,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=-725.6mol/L;
(2)根据平衡时CO的浓度为0.25mol/L可知,反应消耗的H2物质的量为2×2L×0.75mol/L=3mol,则平衡时H2的物质的量浓度为0.5mol/L,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可得,
k=
=
=12(mol/L)-2;
平衡时n(CO)=0.5mol,n(H2)=1mol,n(CH3OH)=1.5mol,共3mol,
起始时,n(CO)=2mol,n(H2))=4mol,共6mol,
根据阿伏加德罗定律可知压强之比等于物质的量之比,10min后,容器内的压强变为原来的
=
倍,
A.因正反应放热,降低温度可使平衡向正反应方向移动,提高CO的转化率,故A正确;
B.加催化剂,平衡不移动,转化率不变,故B错误;
C.充入氩气,使体系压强增大,对于参加反应的物质来说,浓度不变,平衡不移动,转化率不变,故C错误;
D.再充入1molCO和2molH2压强增大,平衡向正反应方向移动,提高CO的转化率,故D正确;
E.恒温恒容改为恒温恒压,压强较恒容时大,增大压强,平衡向正反应方向移动,提高CO的转化率,故E正确.
故答案为:12(mol/L)-2;
;ADE.
CO(g)+
| 1 |
| 2 |
H2的燃烧热为285.8kJ/mol,则H2与氧气反应的热化学方程式为H2(g)+
| 1 |
| 2 |
由图1可知,CO与H2反应可制得甲醇的热化学方程式为:CO(g)+2H2(g)═CH3OH(l);△H=-129kJ/mol③
根据盖斯定律,则CH3OH燃烧热的热化学方程式由①+②×2-③可得:
CH3OH(l)+
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)根据平衡时CO的浓度为0.25mol/L可知,反应消耗的H2物质的量为2×2L×0.75mol/L=3mol,则平衡时H2的物质的量浓度为0.5mol/L,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可得,
k=
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.75mol/L |
| 0.25mol/L×(0.5mol/L)2 |
平衡时n(CO)=0.5mol,n(H2)=1mol,n(CH3OH)=1.5mol,共3mol,
起始时,n(CO)=2mol,n(H2))=4mol,共6mol,
根据阿伏加德罗定律可知压强之比等于物质的量之比,10min后,容器内的压强变为原来的
| 3 |
| 6 |
| 1 |
| 2 |
A.因正反应放热,降低温度可使平衡向正反应方向移动,提高CO的转化率,故A正确;
B.加催化剂,平衡不移动,转化率不变,故B错误;
C.充入氩气,使体系压强增大,对于参加反应的物质来说,浓度不变,平衡不移动,转化率不变,故C错误;
D.再充入1molCO和2molH2压强增大,平衡向正反应方向移动,提高CO的转化率,故D正确;
E.恒温恒容改为恒温恒压,压强较恒容时大,增大压强,平衡向正反应方向移动,提高CO的转化率,故E正确.
故答案为:12(mol/L)-2;
| 1 |
| 2 |
点评:本题考查化学平衡移动以及平衡常数的有关计算,题目难度较大,本题注意热化学方程式的书写.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
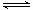 CH3OH
CH3OH
 CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。 CH3OH
CH3OH
 CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的
倍;改变下列条件,能提高CO转化率的是
。
CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的
倍;改变下列条件,能提高CO转化率的是
。