题目内容
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是_____;
(2)已知2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
2SO3(g)△H=﹣196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在2L容积固定不变的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=___ ;
②在①的条件下,判断该反应达到平衡状态的标志是____(填字母).
a.SO2、O2、SO3三者的浓度之比为2:1:2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)
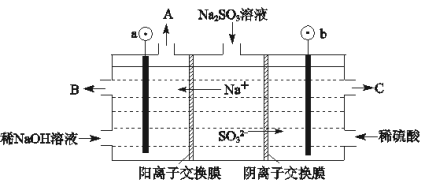
①图中a极要连接电源的(填“正”或“负”)____ 极,C口流出的物质是____;
②SO32﹣放电的电极反应式为 _________ ;
③电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为 _________ g(假设该过程中所有液体进出口密闭)。
【答案】2SO2+2H2O+O2=2H2SO4 0.05mol/(Lmin) bde 负 硫酸 SO32﹣-2e﹣+H2O=SO4 2﹣+2H+ 4.4
【解析】
1)烟尘中含有O2,SO2具有还原性,故SO2在烟尘的催化下形成硫酸是2SO2+2H2O+O2=2H2SO4;
(2)①T温度时,在2L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,
2SO2(g)+O2![]() 2SO3(g)△H<0
2SO3(g)△H<0
起始量(mol/L) 1.0 0.5 0
变化量(mol/L)1×50% 0.25 0.5
平衡量(mol/L) 0..5 0.25 0.5
前5min内O2的平均反应速率=![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
②化学平衡的标志是正逆反应速率相同,各组分含量保持不变;
a.物质的浓度关系和起始量和转化率有关,SO2、O2、SO3三者的浓度之比为2:1:2不能说明反应达到平衡状态,故a不符合;
b.因为该反应为气体物质的量增大的反应,恒温恒容条件下,压强为变量,当容器中气体的压强不变说明达到平衡状态,故b符合;
c.反应前后气体质量不变,容器体积不变,密度在反应过程中和平衡状态都不变,容器中混合气体的密度保持不变不能说明反应达到平衡状态,故c不符合;
d.SO3的物质的量不再变化,能说明反应达到平衡状态,故d符合;
e.SO2的生成速率和SO3的生成速率相等说明正逆反应速率相同,能说明反应达到平衡状态,故e符合;
故答案为:bde;
(3)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,
故答案为:负;硫酸;
②SO32-失去电子被氧化成SO42-,电极反应式为:SO32--2e-+H2O=SO42-+2H+;
③电解过程中阴极区放氢生碱,水变为氢氧化钠,阴极区变化的质量等于氢氧化钠的质量减去消耗水的质量;
根据电子守恒:
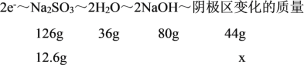
解得x=4.4g
若消耗12.6g Na2SO3,则阴极区变化的质量为4.4 g,故答案为:4.4g。

 阅读快车系列答案
阅读快车系列答案【题目】在恒容条件下,反应:2SO2 (g) + O2 (g) ![]() 2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
容器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A. 在上述条件下反应生成lmol SO3固体放热Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q