题目内容
【题目】下图为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
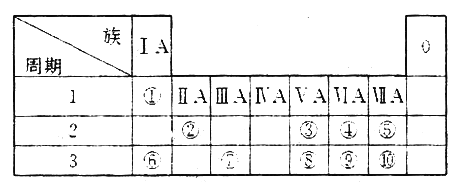
(1)⑤、⑥、⑦ 的离子半径由大到小的顺序为_________。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为_______。(用化学式表示)
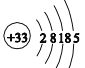
(3)写出⑥在空气中加热生成的产物的电子式:_______。与⑧同族的砷(As)的原子结构示意图为_____________。
(4)⑦和⑩形成的化合物的物理性质非常特殊,其的熔点为190℃(2.02×105Pa),但在180℃就开始升华。据此判断,该是_______(填“共价化合物”或“离子化合物”) , 可以证明你的判断正确的实验依据是________________。
(5)表中所列元素的原子间反应最容易形成离子键的是_________(填元素符号)。⑧与⑩元素形成的常见分子中所有原子______(填“是”或“不是”)都满足最外层为8电子结构。
(6)己知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:______________。
【答案】 F->Na+>Al3+ HClO4>H2SO4>H3PO4 ![]()
 共价化合物 熔融时不导电 NaF 不是 Be(OH)2+2OH-===BeO2 2-+2H2O
共价化合物 熔融时不导电 NaF 不是 Be(OH)2+2OH-===BeO2 2-+2H2O
【解析】本题考查元素周期表和元素周期律的应用,(1)三种元素形成的简单离子是F-、Na+、Al3+,核外电子排布相同,离子半径随着原子序数的递增而减小,因此半径大小顺序是F->Na+>Al3+;(2)最高价氧化物的水化物分别是H3PO4、H2SO4、HClO4,非金属性越强,其最高价氧化物的水化物酸性增强,同周期从左向右非金属性增强,即酸性强弱是HClO4>H2SO4>H3PO4;(3)Na在空气中点燃,生成Na2O2,其电子式为:![]() ;As是33号元素,As的原子结构示意图为:
;As是33号元素,As的原子结构示意图为: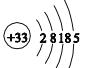 ;(4)形成化合物为AlCl3,熔点较低,且易升华,这是分子晶体的特点,即AlCl3是共价化合物;共价化合物在熔融状态下,不导电,因此利用氯化铝熔融状态下是否导电,证明的实验依据是熔融的氯化铝不导电;(5)最容易形成离子键,应是最容易失去电子和最容易得到电子,最容易失去电子的是Na,最容易得到电子是F,因此形成的化合物是NaF;形成的化合物是PCl3和PCl5,PCl3所有原子的最外层都满足8电子稳定结构,PCl5中P的最外层超过8电子,故填“不是”;(6)氢氧化铝表现两性,则Be(OH)2表现两性,因此离子反应方程式为:Be(OH)2+2OH-=BeO22-+2H2O。
;(4)形成化合物为AlCl3,熔点较低,且易升华,这是分子晶体的特点,即AlCl3是共价化合物;共价化合物在熔融状态下,不导电,因此利用氯化铝熔融状态下是否导电,证明的实验依据是熔融的氯化铝不导电;(5)最容易形成离子键,应是最容易失去电子和最容易得到电子,最容易失去电子的是Na,最容易得到电子是F,因此形成的化合物是NaF;形成的化合物是PCl3和PCl5,PCl3所有原子的最外层都满足8电子稳定结构,PCl5中P的最外层超过8电子,故填“不是”;(6)氢氧化铝表现两性,则Be(OH)2表现两性,因此离子反应方程式为:Be(OH)2+2OH-=BeO22-+2H2O。

 阅读快车系列答案
阅读快车系列答案