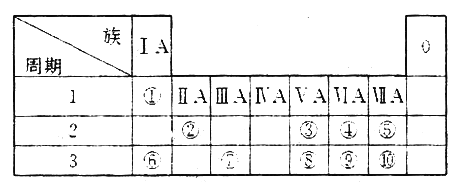
题目内容
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。
Ⅰ.实验步骤
(1)配制100ml待测白醋溶液:用 (填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴 作指示剂。
![]()
(3)读取盛装0.1000 mol·L-1 NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
(4)滴定。当___________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00[ | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可得c(市售白醋)= mol·L-1;
市售白醋总酸量= g·100 mL-1。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
【答案】I.(1)酸式滴定管(或10mL移液管);100ml容量瓶;(2)酚酞;(3)0.60;(每空1分)
(4)溶液由无色恰好变为红色(或粉红色),并在半分钟内不褪色;(2分,)
III.(1)0.75;4.5;(每空2分)(2)ab(2分,错选、多选不给分,漏选给1分)
【解析】
试题分析:Ⅰ.(1)用酸式滴定管(或10mL移液管)(量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL 容量瓶中定容,摇匀即得待测白醋溶液;
(2)食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞;
(3)滴定管液面的读数0.60mL;
(4)NaOH滴定食醋的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅲ.(1)第1次滴定误差明显大,属异常值,应舍去;3次消耗的NaOH溶液的体积为:15.00mL;15.05mL;14.95mL;则NaOH溶液的体积的平均值为15.00mL;设10mL市售白醋样品中 CH3COOH 的物质的量浓度为x,则
CH3COOH~NaOH
1mol 1mol
0.2x 0.1000mol/L×0.015L
则c(市售白醋)=![]() =0.75mol/L
=0.75mol/L
样品总酸量为0.75mol/L×0.2L×60g/mol×![]() =4.50g/100mL;
=4.50g/100mL;
(2)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=![]() 分析可知c(待测)偏大,a正确;b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
分析可知c(待测)偏大,a正确;b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 分析可知c(待测)偏大,b正确;c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=
分析可知c(待测)偏大,b正确;c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=![]() 分析可知c(待测)不变,c错误;d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=
分析可知c(待测)不变,c错误;d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=![]() 分析可知c(待测)偏小,d错误;答案选ab。
分析可知c(待测)偏小,d错误;答案选ab。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案