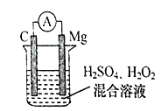
题目内容
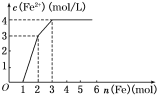
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示,则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为____,按反应的先后顺序写出该过程的离子反应方程式:___________。
【答案】1:1:4 Fe+4H++NO3-= Fe3++NO↑+2H2O 2 Fe3++ Fe=3 Fe2+ Cu 2++ Fe=Fe2++Cu
【解析】
氧化性顺序为HNO3>Fe (NO3) 3>Cu (NO3) 2,加入铁后,铁依次发生氧化还原反应,根据发生的反应结合图像分析解答。
稀溶液中各物质的氧化性顺序为HNO3>Fe(NO3)3>Cu(NO3) 2,加入铁后会依次发生氧化还原反应,①Fe+4H++NO3-= Fe3++NO↑+2H2O;②Fe+2Fe3+=3Fe2+;③Fe+Cu2+=Cu+Fe2+;从图像中可知铁为1mol时,无Fe2+生成,发生的反应①,消耗硝酸为4mol,生成Fe3+1mol;再加入1mol铁发生反应②,生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量1mol;再加入1mol铁发生反应③,此时又生成Fe2+1mol,说明原溶液中Cu2+物质的量为1mol;综上所述可知原溶液中Fe (NO3) 3为1mol,Cu (NO3) 2物质的量为1mol,HNO3物质的量为4mol,稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1∶1∶4,故答案为:1∶1∶4;Fe+4H++NO3-= Fe3++NO↑+2H2O;Fe+2Fe3+=3Fe2+;Fe+Cu2+=Cu+Fe2+。