题目内容
在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性。现有下列两个反应:①2ICl+2Zn= ZnCl2+ZnI2;②ICl+H2O=HCl+HIO。下列关于ICl性质的叙述正确的是
| A.反应①中,当转移0.4mol电子时生成13.6gZnCl2; |
| B.反应①中,ZnCl2是氧化产物,ZnI2是还原产物 |
| C.反应①中,ZnCl2既是氧化产物又是还原产物; |
| D.反应②中,ICl既是氧化剂又是还原剂 |
A
解析试题分析:A、ICl中氯元素为-1价,在反应①中,当转移0.4mol电子时即0.2mol的Zn参加反应时,生成0.1molZnCl2,其质量为13.6g,正确;B、反应①中,因为ICl中氯元素为-1价,碘为+1,ZnCl2是氧化产物,ZnI2既是氧化产物又是还原产物,错误;C、反应①中,ZnCl2只是氧化产物,错误;D、反应②是非氧化还原反应,错误,答案选A。
考点:考查对氧化还原反应、氧化产物、还原产物的判断及计算

下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是
| A.C+HNO3 | B.SO2+HNO3 | C.Fe(OH)3+HNO3 | D.FeO+HNO3 |
下列过程中不涉及氧化还原反应的是( )
| A.用SO2漂白纸浆和草帽辫 |
| B.用氯化铁溶液腐蚀印刷线路板上的铜膜 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.高温下用焦炭还原SiO2制取粗硅 |
科学家最近用金属钠还原CCl4和SiCl4制得一种一维SiC纳米捧。相关反应的化学方程式为:8Na+CCl4十SiCl4=SiC十8NaCl。下列说法不正确的是( )
| A.一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力 |
| B.上述反应中SiC既是氧化产物又是还原产物 |
| C.SiCl4是由极性键构成的非极性分子 |
| D.CCl4分子、SiCl4分子、SiC晶体中各原子都达到了8电子稳定结构 |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。下列说法中不正确的是( )。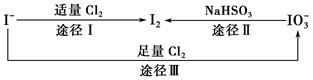
| A.用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )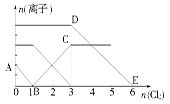
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6 mol/L |
| C.当通入Cl2 2 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
为实现中国消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以碘酸钾(KIO3)形式存在,已知在溶液中I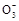 可和I-发生反应:I
可和I-发生反应:I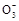 +5I-+6H+
+5I-+6H+ 3I2+3H2O,根据此反应,可用试纸和一些生活中常见物质进行实验,证明食盐中存在I
3I2+3H2O,根据此反应,可用试纸和一些生活中常见物质进行实验,证明食盐中存在I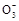 ,可供选用的物质有:①自来水②蓝色石蕊试纸,③碘化钾淀粉试纸④淀粉⑤食糖⑥食醋⑦白酒。进行上述实验时必须使用的物质是( )。
,可供选用的物质有:①自来水②蓝色石蕊试纸,③碘化钾淀粉试纸④淀粉⑤食糖⑥食醋⑦白酒。进行上述实验时必须使用的物质是( )。
| A.①③ | B.③⑥ | C.②④⑥ | D.①②④⑤⑦ |
古代曾用绿矾加强热得到硫酸、红色粉末和有刺激性气味的气体,此反应属于( )
| A.有氧化还原的分解反应 |
| B.无氧化还原的分解反应 |
| C.只是氧化还原反应 |
| D.只是分解反应 |