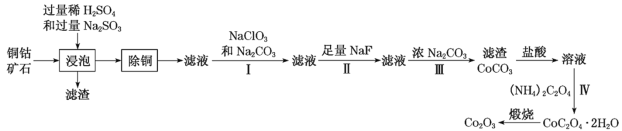
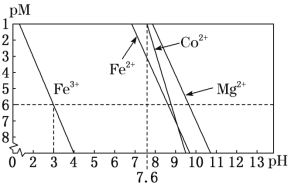
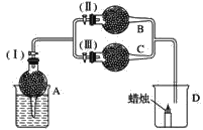
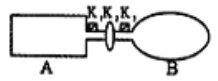
题目内容
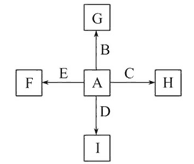
【题目】如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
回答问题:
(1)①中反应的化学方程式为:________________________________________;
(2)1.6 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出离子方程式和计算过程);__________________________________________。
(3)C与过量NaOH溶液反应的离子方程式为:___________________________,反应后溶液与过量化合物I反应的离子方程式为:_________________________;
(4)E在I中燃烧观察到的现象是:____________________________________。
【答案】![]()
![]()
![]()
![]() ,至少需铜粉的质量为0.01 mol×64 g/mol=0.64 g
,至少需铜粉的质量为0.01 mol×64 g/mol=0.64 g ![]()
![]() 镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体
镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体
【解析】
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的化合物,已知:①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接,发生的是铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,推断A为O2,;
B+H能放出大量的热,该反应曾应用于铁轨的焊接,发生的是铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,推断A为O2,;
②I是一种常见的温室气体为CO2,它和E可以发生反应:2E+I![]() 2F+D,推断E为Mg,F为MgO,D为C,计算F中的E元素的质量分数=
2F+D,推断E为Mg,F为MgO,D为C,计算F中的E元素的质量分数=![]() ×100%=60%,符合;然后结合元素化合物知识及化学用语来解答。
×100%=60%,符合;然后结合元素化合物知识及化学用语来解答。
(1)铝热反应应用于铁轨的焊接,由①可知C为Al、G为Fe2O3、B为Fe、H为Al2O3,反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3。CO2是最常见的温室气体,由②可知E为Mg、I为CO2、F为MgO、D为C。综上可知A为O2。
2Fe+Al2O3。CO2是最常见的温室气体,由②可知E为Mg、I为CO2、F为MgO、D为C。综上可知A为O2。
(2)Fe2O3与盐酸反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,FeCl3与铜粉完全反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,可知n(Cu)=n(Fe2O3)=![]() ="0.01" mol,需铜粉的质量为0.01 mol×64 g/mol=0.64g。
="0.01" mol,需铜粉的质量为0.01 mol×64 g/mol=0.64g。
(3)Al与过量NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=![]() +
+
3H2↑,反应后溶液为NaAlO2,与过量CO2反应的离子方程式为:![]() 。
。
(4)Mg在CO2中燃烧的化学方程式为:2Mg+CO2![]() 2MgO+C,观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体。
2MgO+C,观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着黑色固体。

 阅读快车系列答案
阅读快车系列答案【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,下列研究目的和示意图相符的是
2NH3(g)ΔH<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响P2>P1 | 温度对反应的影响 | 平衡体系增加氮气对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A. AB. BC. CD. D
【题目】某有机物的结构简式如下:
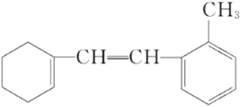
(1)该物质苯环上一氯代物有____________________种;
(2)1 mol该物质和溴水混合,消耗Br2的物质的量为____________________mol;
(3)1 mol该物质和H2加成最多需H2____________________mol;
(4)下列说法不正确的是____________________。
A.此物质可发生加成、取代、氧化等反应 |
B.该物质易溶于水 |
C.该物质能使溴水褪色 |
D.该物质能使酸性KMnO4溶液褪色 |
E.分子式是C15H18