题目内容
【题目】成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入_________,溶液变蓝,则苹果中含有淀粉。
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有____________(写分子式)。
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做_____________。
②写出化合物A与CH3COOH反应的化学方程式为______________________,该反应的类型为_____。
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比_______。苹果酸的分子式是___________。
【答案】碘水 C6H12O6 消毒剂 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 取代反应 2:3 C4H6O5
CH3COOCH2CH3+H2O 取代反应 2:3 C4H6O5
【解析】
(1)淀粉的特性是遇碘水变蓝;
(2)能与新制Cu(OH)2悬浊液加热反应,产生砖红色的沉淀的是葡萄糖,葡萄糖的分子式为C6H12O6;
(3)葡萄糖在一定条件下得到的分子式为C2H6O的化合物A为CH3CH2OH,
①75%的乙醇溶液是医用酒精,可以做消毒剂;
②乙醇可以与乙酸发生酯化反应,反应的化学方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,该反应属于取代反应。
CH3COOCH2CH3+H2O,该反应属于取代反应。
(4)0.02mol苹果酸燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g和3.52g,无水CaCl2增重的质量是水的质量,所以n(H2O)=1.08g÷18g/mol=0.06mol,碱石灰增重的质量是CO2的质量,所以n(CO2)=3.52g÷44g/mol=0.08mol,因此分子中C、H原子的个数比为0.08mol:(0.06mol×2)=2:3;n(苹果酸):n(C):n(H)=0.02mol:0.08mol:(0.06mol×2)=1:4:6,苹果酸的分子式为C4H6Ox,苹果酸的相对分子质量为134,4×12+6×1+16x=134,解得x=5,苹果酸的分子式为C4H6O5。

【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________,T1=_______;通过实验___________可探究出温度变化对化学反应速率的影响。
(2)C组实验中液褪色时间t1______(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________。(用含有t1的式子表示)
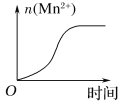
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________。