题目内容
【题目】I.300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8mol D。
(1)300℃时,该反应的平衡常数表达式为K=___已知K300℃<K350℃,则ΔH___0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为____,D的平均反应速率为___。
(3)若温度不变,缩小容器容积,则A的转化率____(填“增大”“减小”或“不变”)。
II.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
(已知:2NO2![]() N2O4 ΔH<0)
N2O4 ΔH<0)
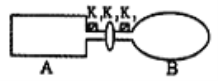
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)___(填“>”、“<”、“=”)v(B);若打开活塞K2,气球B将___(填“增大”、“减小”、“不变”)。
(2)室温下,若A、B都保持体积不变,将A套上—个绝热层,B与外界可以进行热传递,则达到平衡时,___中的颜色较深。
【答案】![]() > 0.8mol/L 0.2mol/(L·min) 不变 < 减小 A
> 0.8mol/L 0.2mol/(L·min) 不变 < 减小 A
【解析】
I. 3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q
2C(g)+2D(g) ΔH=Q
初始2mol 2mol
反应1.2 0.4 0.8 0.8
2min 0.8 1.6 0.8 0.8
II.关闭K2时,装置A为恒容装置,装置B为恒压装置。
I.(1)K=![]() ;已知K300℃<K350℃,升高温度,K值增大,平衡正向移动,则正反应为吸热反应,则ΔH>0;
;已知K300℃<K350℃,升高温度,K值增大,平衡正向移动,则正反应为吸热反应,则ΔH>0;
(2)在2min末时,B的物质的量为1.6mol,其平衡浓度为1.6mol/2L=0.8mol/L;D的物质的量为0.8mol,v(D)=0.8mol/(2L×2min)=0.2mol/(L·min);
(3)若温度不变,缩小容器容积,增大压强,方程式两边气体的计量数不变,则平衡不移动,A的转化率不变;
II.(1)已知等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同,装置B为等压,相当于装置A平衡后再增大压强,体积减小,c(N2O4)增大,则v(A)< v(B);若打开活塞K2,整个装置为恒压装置,压强增大,平衡正向移动,则总体积减小,A容积不变,则B的体积减小,气球B体积减小;
(2)室温下,将A套上—个绝热层,则A中随反应的进行温度逐渐升高,则平衡逆向移动,c(NO2)增大,颜色比装置B中深。

【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol