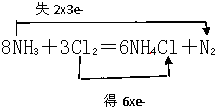题目内容
1. 根据反应8NH3+3Cl2 = 6NH4Cl+N2,回答下列问题。
(1)还原剂是 (填化学式)。
(2)氧化剂与氧化产物的质量比为(填整数比) 。
(3)当生成28g N2时,被氧化的物质有 克。
(4)该反应发生还原反应的过程可以表示为Cl2+2e- = 2Cl-(或3Cl2+6e- = 6Cl-),则发生氧化反应的过程可表示为 。
【答案】
1、(1) NH3 (2) 213:28 (3) 34 (4)8NH3-6e-=6NH4++N2
【解析】
试题分析:(1)根据方程式可知,氨气中氮元素的化合价升高,被氧化,所以氨气是还原剂。
(2)氧化剂是氯气,而氧化产物是氮气,所以二者的质量之比是3×71︰28=213︰28。
(3)28g氮气是1mol,所以被氧化的氨气是2mol,质量是2mol×17g/mol=34g。
(4)根据电子的得失守恒可知,总反应式减去3Cl2+6e- = 6Cl-即得到氧化反应的反应式,所以应该是8NH3-6e-=6NH4++N2。
考点:考查氧化还原反应的有关计算和判断
点评:在进行氧化还原反应的有关判断时,关键是准确标出有关元素的化合价。而在进行计算是有关利用电子的得失守恒。

练习册系列答案
相关题目