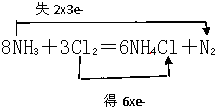题目内容
根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题.
(1)氧化剂是
(2)反应中转移电子数是
(3)氧化剂与氧化产物的质量比
(4)当生成28g N2时,被氧化的物质的质量是
(1)氧化剂是
Cl2
Cl2
;(2)反应中转移电子数是
6e-
6e-
;(3)氧化剂与氧化产物的质量比
213:28
213:28
;(4)当生成28g N2时,被氧化的物质的质量是
34
34
g.分析:(1)根据反应8NH3+3Cl2=6NH4Cl+N2,反应前后元素化合价变化分析判断,化合价降低的得到电子做氧化剂;
(2)依据元素化合价变化结合电子守恒计算电子转移数;
(3)元素化合价降低的做氧化剂,元素化合价升高的做还原剂被氧化得到氧化产物;
(4)依据化学方程式结合被有害物质的判断计算得到.
(2)依据元素化合价变化结合电子守恒计算电子转移数;
(3)元素化合价降低的做氧化剂,元素化合价升高的做还原剂被氧化得到氧化产物;
(4)依据化学方程式结合被有害物质的判断计算得到.
解答:解:(1)据反应8NH3+3Cl2=6NH4Cl+N2,反应中氯元素化合价从0价变化为-1价,化合价降低做氧化剂,故答案为:Cl2;
(2)元素化合价变化分析,3molCL2化合价从0价变化为-1价,电子转移为6mole-;和2molNH3做还原剂失电子数相同,故答案为:6e-;
(3)反应8NH3+3Cl2=6NH4Cl+N2,氯气做氧化剂,氨气做还原剂,氧化产物为N2;3molCl2氧化2molNH3,得到1mol氧化产物N2,所以氧化剂和氧化产物质量比为:
3×71:1×28=213:28;故答案为:213:28;
(4)当生成28g N2时,氮气物质的量为1mol,被氧化的物质为2molNH3,被氧化的氨气质量=2mol×17g/mol=34g;
故答案为:34.
(2)元素化合价变化分析,3molCL2化合价从0价变化为-1价,电子转移为6mole-;和2molNH3做还原剂失电子数相同,故答案为:6e-;
(3)反应8NH3+3Cl2=6NH4Cl+N2,氯气做氧化剂,氨气做还原剂,氧化产物为N2;3molCl2氧化2molNH3,得到1mol氧化产物N2,所以氧化剂和氧化产物质量比为:
3×71:1×28=213:28;故答案为:213:28;
(4)当生成28g N2时,氮气物质的量为1mol,被氧化的物质为2molNH3,被氧化的氨气质量=2mol×17g/mol=34g;
故答案为:34.
点评:本题考查了氧化还原反应的概念分析判断,氧化还原反应电子转移的计算,准确掌握概念,判断氧化剂还原剂,氧化产物,还原产物,元素化合价变化是解题关键.

练习册系列答案
相关题目