题目内容
根据题意,完成下列化学用语的填空.
(1)请你写出焙制糕点所用发酵粉中主要钠盐的化学式:
(2)请你写出工业上用氯气和消石灰反应制取漂白粉的化学反应方程式:
(3)根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:该反应中氧化剂是
 用双线桥法标出该反应电子转移的方向与数目.
用双线桥法标出该反应电子转移的方向与数目.
 .
.
(1)请你写出焙制糕点所用发酵粉中主要钠盐的化学式:
NaHCO3
NaHCO3
.(2)请你写出工业上用氯气和消石灰反应制取漂白粉的化学反应方程式:
2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O
.(3)根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:该反应中氧化剂是
氯气
氯气
,画出其离子的结构示意图



分析:(1)发酵粉中主要钠盐是碳酸氢钠;
(2)氯气和消石灰反应生成氯化钙、次氯酸钙和水;
(3)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,根据化合价变化判断氧化剂.
(2)氯气和消石灰反应生成氯化钙、次氯酸钙和水;
(3)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,根据化合价变化判断氧化剂.
解答:解:(1)发酵粉中主要钠盐是碳酸氢钠,其化学式为:NaHCO3,故答案为:NaHCO3;
(2)氯气和消石灰反应生成氯化钙、次氯酸钙和水,反应方程式为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(3)8NH3+3Cl2=6NH4Cl+N2中氯元素化合价由0价变为-1价,氮元素化合价由-3价变为0价,所以氯气是氧化剂,氯离子核外有18个电子,其结构示意图为: ,该反应中得失电子数=3×2×(1-0)=6,所以该反应电子转移的方向与数目
,该反应中得失电子数=3×2×(1-0)=6,所以该反应电子转移的方向与数目 ,
,
故答案为:氯气; ;
; .
.
(2)氯气和消石灰反应生成氯化钙、次氯酸钙和水,反应方程式为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(3)8NH3+3Cl2=6NH4Cl+N2中氯元素化合价由0价变为-1价,氮元素化合价由-3价变为0价,所以氯气是氧化剂,氯离子核外有18个电子,其结构示意图为:
 ,该反应中得失电子数=3×2×(1-0)=6,所以该反应电子转移的方向与数目
,该反应中得失电子数=3×2×(1-0)=6,所以该反应电子转移的方向与数目 ,
,故答案为:氯气;
 ;
; .
.点评:本题考查了氧化还原反应,难点是电子转移的方向和数目,难度较大.

练习册系列答案
相关题目
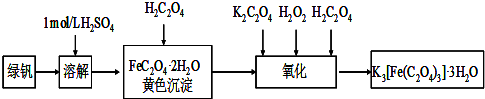
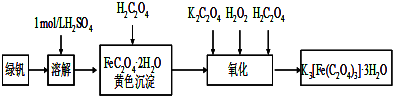
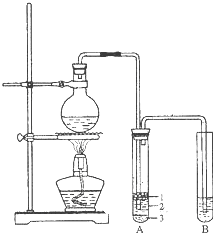 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: