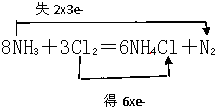题目内容
根据反应8NH3+3Cl2═6NH4Cl+N2,回答下列问题:
(1)还原剂是
(2)用双线桥法表示该反应电子转移的方向和数目
 ;
;
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为
(1)还原剂是
NH3
NH3
(写化学式);(2)用双线桥法表示该反应电子转移的方向和数目


(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为
22.4
22.4
升.分析:反应8NH3+3Cl2═6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,该反应中转移6e-,以此来解答.
解答:解:(1)反应中N元素的化合价降低,则还原剂为NH3,故答案为:NH3;
(2)用双线桥标出电子转移的方向和数目可为 ,故答案为:
,故答案为: ;
;
(3)由反应可知,生成1mol氮气转移6mol电子,当反应中转移1.806×1024个电子时,被氧化的气体体积为
×
mol×2×22.4L/mol=22.4L,
故答案为:22.4.
(2)用双线桥标出电子转移的方向和数目可为
 ,故答案为:
,故答案为: ;
;(3)由反应可知,生成1mol氮气转移6mol电子,当反应中转移1.806×1024个电子时,被氧化的气体体积为
| 1.806×1024 |
| 6.03×1023 |
| 1 |
| 6 |
故答案为:22.4.
点评:本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目