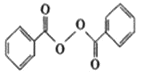
题目内容
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=_________,V2=___________。
(2)根据上表中实验①、②的数据,可以得到的结论是_________________________________。
(3)探究温度对化学反应速率的影响,应选择__________(填实验编号)。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
该小组同学提出的假设是___________________________________________。
【答案】2.0 3.0 其他条件不变时,增大(减小)反应物浓度,化学反应速率加快(减慢) ②③ Mn2+对该反应有催化效果
【解析】
(1).利用实验2、3中的数据,可知溶液的总体积为10.0mL,所以实验1中![]() =2.0mL,
=2.0mL,![]() =3.0mL;
=3.0mL;
(2).实验①、②其他条件相同,只有![]() 浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时问更短,则浓度大,反应速率大;
浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时问更短,则浓度大,反应速率大;
(3).实验2和③的温度不同,其他条件相同;
(4).由①④可知,反应中的变量为是否加入![]() ,故本实验为验证Mn2+对该反应有催化效果;
,故本实验为验证Mn2+对该反应有催化效果;
(1).利用实验2、3中的数据,可知溶液的总体积为10.0mL,所以实验1中![]() =2.0mL,
=2.0mL,![]() =3.0mL,故答案为:2.0,3.0;
=3.0mL,故答案为:2.0,3.0;
(2) 实验①、②其他条件相同,只有![]() 浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时间更短,则浓度大,反应速率大故答案为:其他条件不变时,增大(减小)反应物浓度,加快(減慢)化学反应速率;
浓度不同,则实验①、②探究的是浓度对反应速率的影响,根据表中的实验数据,实验①的草酸浓度大,溶液褪至无色所需时间更短,则浓度大,反应速率大故答案为:其他条件不变时,增大(减小)反应物浓度,加快(減慢)化学反应速率;
(3).为探究温度对化学反应速率的影响,必须温度不同,其他条件相同,实验②和③满故答案为:②③;
(4).由①④可知,反应中的变量为是否加入![]() ,故本实验为验证Mn2+对该反应有催化效果;
,故本实验为验证Mn2+对该反应有催化效果;

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________