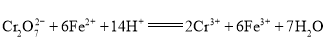��Ŀ����
����Ŀ���ȼ��仯�����й㷺��;������������һ�����͵���������
��NaClO2��Cl�Ļ��ϼ�Ϊ____________��
��ʵ�������������Ũ���ᷴӦ�Ʊ�ClO2�������ClO2�⣬����Cl2��KCl�ȣ�д���÷�Ӧ�Ļ�ѧ����ʽ __________��������11.2L��������״������ת�Ƶ�����Ϊ _________��
��ClO2��Cl2������ʱ����������ԭΪCl�������³�ѹ�£��������ClO2������������Cl2��_________����
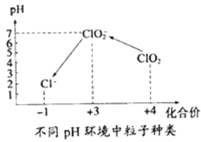
������ˮ����ClO2�������ˮ�У�Ҫ��ClO2��Ũ����0.1��0.8 mgL��1֮�䡣���������Լ��ˮ��ClO2��Ũ�ȣ���ͬpH����������������ͼ��ʾ�����������£�
��.ȡһ�������ˮ��������һ�����ĵ⻯�أ��ٽ���Ӧ����Һ�������ԣ������������Һ����Һ������
��.����һ������Na2S2O3��Һ������֪��2S2O32��+I2�TS4O62��+2I����
��.���������ˮ��pH��1��3��
���ʴ�
��ˮ�������Ϊ1.0L���ڲ���IIʱ������1.0��10��3molL��1��Na2S2O3��Һ10mL����ˮ����ClO2��Ũ����_____ mgL��1��
���𰸡�+3 2KClO3+4HCl=2KCl+2ClO2��+Cl2��+2H2O NA��6.02��1023 2.5 0.675
��������
���ɻ��ϼ۴�����Ϊ0�ж�Cl�Ļ��ϼۣ�
��ʵ�������������Ũ���ᷴӦ�Ʊ�ClO2�������ClO2�⣬����Cl2��KCl�ȣ����ݻ��ϼ�����������ȡ�ԭ���غ����д��Ӧ�Ļ�ѧ����ʽ����ϻ��ϼ۵ı仯����ת�Ƶ��ӵ���Ŀ��
�۸��ݵ���ת����Ŀ�����жϣ�
�ܲ���I������Һ�����ԣ���������ClO2������ĵ⻯������ΪI2����������ԭ��ClO2-�����ݻ��ϼ�����������ȡ�ԭ���غ�͵���غ�����ƽ��Ӧ����ʽ������II����һ���� Na2S2O3��Һ��������Ӧ2S2O32-+I2�TS4O62-+2I-��ʹI2��ԭΪI-���Ӷ��ɵù�ϵS2O32-��I-��ClO2���ȼ����ClO2�����ʵ�����Ȼ���ټ����Ũ�ȡ�
��NaClO2��NaΪ+1�ۡ�OΪ2�ۣ��ɻ��ϼ۴�����Ϊ0��֪ClΪ+3�ۣ��ʴ�Ϊ��+3��
��ʵ�������������Ũ���ᷴӦ�Ʊ�ClO2�������ClO2�⣬����Cl2��KCl�ȣ���֪��Ӧ�ķ���ʽΪ2KClO3+4HCl=2KCl+2ClO2��+Cl2��+2H2O���ɷ���ʽ��֪����11.2L��������0.5mol��Ӧ����1molKClO3����Ӧ��KClO3��ClԪ�ػ��ϼ���+5�۽��͵�+4�ۣ�HCl��ClԪ�ػ��ϼ���-1�����ߵ�0�ۣ�������0.5mol����ת��1mol���ӣ���ĿΪNA��6.02��1023���ʴ�Ϊ��2KClO3+4HCl=2KCl+2ClO2��+Cl2��+2H2O��NA��6.02��1023��
��C1O2��Cl2������ʱ����������ԭΪCl��ÿ1molC1O2����ԭΪCl��Ҫ��5mol���ӣ�ÿ1molC12����ԭΪCl��Ҫ��2mol���ӣ����ݵ���ת����Ŀ��ȿ�֪�������C1O2����������Cl2��2.5�����ʴ�Ϊ��2.5��
�ܲ���I������Һ�����ԣ���������ClO2������ĵ⻯������ΪI2����������ԭ��ClO2-��������Ӧ��2ClO2+2I-=2ClO2-+I2������II����һ����Na2S2O3��Һ��������Ӧ2S2O32-+I2�TS4O62-+2I-��ʹI2��ԭΪI-����ɫ����ʧ���ɵù�ϵʽ��2S2O32~I2~2ClO2��n(ClO2)=n(S2O32-)=1.0��105mol��m(ClO2)=n(ClO2)��M(ClO2)=1.0��105mol��67.5gmol1=6.75��10-4g=0.675mg������ˮ��Ϊ1L������ClO2��Ũ��Ϊ��![]() ���ʴ�Ϊ��0.675��
���ʴ�Ϊ��0.675��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�