题目内容
T、X、Y、Z、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W原子最外层有1个电子,属于ds区元素,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是 __________ ___(用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的价层电子排布式为 ,该元素与元素Y 、T能形成的[W(YT3)4]2+离子中,含有的化学键是 。
a.离子键 b.极性键 c.非极性键 d.配位键
画出其结构式_____________
(4) T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取_____ 杂化,1molM分子中σ键和π键的个数比为 。
(5) T和Z可以形成个数比为1:1的分子,其中中心原子采取 杂化;通常情况下,该分子与水任意比互溶的主要原因是 。
①W原子最外层有1个电子,属于ds区元素,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是 __________ ___(用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的价层电子排布式为 ,该元素与元素Y 、T能形成的[W(YT3)4]2+离子中,含有的化学键是 。
a.离子键 b.极性键 c.非极性键 d.配位键
画出其结构式_____________
(4) T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取_____ 杂化,1molM分子中σ键和π键的个数比为 。
(5) T和Z可以形成个数比为1:1的分子,其中中心原子采取 杂化;通常情况下,该分子与水任意比互溶的主要原因是 。
(1)N>O>C (2)Cl的原子半径比N大
(3)S,略 ;b d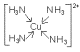
(4)sp2 ;3:1
(5)sp3 H2O2分子与水分子间形成氢键(相似相溶)
(3)S,略 ;b d

(4)sp2 ;3:1
(5)sp3 H2O2分子与水分子间形成氢键(相似相溶)
由题意可知:T、X、Y、Z、R、W对应元素为:H、C、N、O、CL、Cu;所以
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是N>O>C
(2)Y的氢化物为氨气,R的氢化物为HCL,氨气分子间易形成氢键,原因是Cl的原子半径比N大;
(3)W的基态原子的价层电子排布式为1s22s22p63s23p63d104s2;该元素与元素Y 、T能形成的[W(YT3)4]2+离子中,含有的化学键是:b d;其结构式为:
(4)XT2Z的分子式为CH2O,呈平面三角形,则C原子采取sp2 杂化;1molM分子中σ键和π键的个数比为3:1;
(5)T和Z可以形成个数比为1:1的分子为H2O2;其中中心原子采取sp3杂化,通常情况下,H2O2与水任意比互溶的主要原因是:H2O2分子与水分子间形成氢键(相似相溶)
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是N>O>C
(2)Y的氢化物为氨气,R的氢化物为HCL,氨气分子间易形成氢键,原因是Cl的原子半径比N大;
(3)W的基态原子的价层电子排布式为1s22s22p63s23p63d104s2;该元素与元素Y 、T能形成的[W(YT3)4]2+离子中,含有的化学键是:b d;其结构式为:

(4)XT2Z的分子式为CH2O,呈平面三角形,则C原子采取sp2 杂化;1molM分子中σ键和π键的个数比为3:1;
(5)T和Z可以形成个数比为1:1的分子为H2O2;其中中心原子采取sp3杂化,通常情况下,H2O2与水任意比互溶的主要原因是:H2O2分子与水分子间形成氢键(相似相溶)

练习册系列答案
相关题目
 其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题: 4
4 键。在H-Y、H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。
键。在H-Y、H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。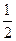 O2(g)====XO2(g) ΔH=-283kJ·mol-1
O2(g)====XO2(g) ΔH=-283kJ·mol-1