题目内容
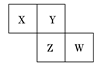
X、Y、Z、W四种元素在周期表中相对位置如图,Y、Z质子数之和为21,下列说法正确的是
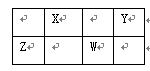

| A.常压下,四种元素单质中,W单质的熔点最高 |
| B.Z的阳离子与Y的阴离子电子层结构相同 |
| C.X的气态氢化物比Y的气态氢化物稳定 |
| D.W元素的金属性比Z元素金属性强 |
B
Y、Z质子数之和为21,说明两周期同主族元素的序数差不可能为18或以上,则设Y的质子数为a,则Z的质子数为a+5,则2a+5=21,a=8,则X、Y、Z、W四种元素分别为C、O、Al、P
A:四种单质中C单质为原子晶体,熔点最高,不正确
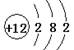
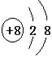
B:两离子的电子层结构均两层,分别排2、8个电子,正确
C:同周期,自左向右元素的非金属性增强,对应气态氢化物的稳定性增强,不正确
D:同周期,自左向右元素的金属性减弱,不正确
答案为B
A:四种单质中C单质为原子晶体,熔点最高,不正确
B:两离子的电子层结构均两层,分别排2、8个电子,正确
C:同周期,自左向右元素的非金属性增强,对应气态氢化物的稳定性增强,不正确
D:同周期,自左向右元素的金属性减弱,不正确
答案为B

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
 ,
,
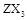 型化合物,常温下W的单质为气态。
型化合物,常温下W的单质为气态。 ,属于 化合物(填
,属于 化合物(填 “离子”或“共价”)。
“离子”或“共价”)。 列问题:
列问题: )是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为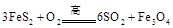 ,有3mol
,有3mol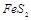 参加反应,转移 mol电子。
参加反应,转移 mol电子。 。
。