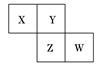
题目内容
(12分)在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1) 锂在空气中燃烧主要产物的电子式是 ,同时生成少量的 。
(2)铍的最高价氧化物对应的水化物的化学式是 ,它属 化合物(选填“酸性”、“碱性”、“两性”),写出证明此结论的离子方程式
(3)用电子式表示BeCl2的形成过程: 。
(4)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3固体与过量的NaOH溶液反应的离子方程式为 。
(5)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
。
(1) 锂在空气中燃烧主要产物的电子式是 ,同时生成少量的 。
(2)铍的最高价氧化物对应的水化物的化学式是 ,它属 化合物(选填“酸性”、“碱性”、“两性”),写出证明此结论的离子方程式
(3)用电子式表示BeCl2的形成过程: 。
(4)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3固体与过量的NaOH溶液反应的离子方程式为 。
(5)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
。
(1)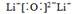 Li3N
Li3N
(2)Be(OH)2 两性
Be(OH)2+2H+===Be2++2H2O
Be(OH)2+2OH-===BeO22—+2H2O
(3)Al4C3+4OH-+4H2O ===4AlO2—+3CH4↑
===4AlO2—+3CH4↑
(4)将BeCl2加热到熔融状态不能导电证明BeCl2是共价化合物
(5)
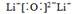 Li3N
Li3N(2)Be(OH)2 两性
Be(OH)2+2H+===Be2++2H2O
Be(OH)2+2OH-===BeO22—+2H2O
(3)Al4C3+4OH-+4H2O
 ===4AlO2—+3CH4↑
===4AlO2—+3CH4↑(4)将BeCl2加热到熔融状态不能导电证明BeCl2是共价化合物
(5)

略

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
 ,
,