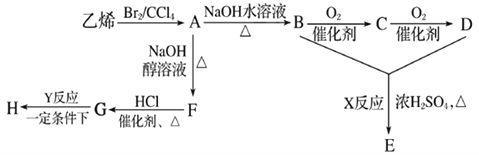
题目内容
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
【答案】D
【解析】根据盖斯定律,用①-②得:Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s) ΔH=-348.3 kJ/mol-(-31.0 kJ/mol)=-317.3 kJ/mol,C选项单位错误,若增大2倍,则为:2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1,正确。答案选D。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入体积不变的容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入体积不变的容器内各组分的物质的量见下表:
CO2 | H2 | CO | H2O | |
甲 | 2a mol | 2a mol | 0 | 0 |
乙 | 2a mol | a mol | 0 | 0 |
丙 | 0 | 0 | 2a mol | 2a mol |
丁 | amol | 0 | a mol | a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙>丁>甲>丙 B. 乙=丁<丙=甲
C. 丁>乙>丙=甲 D. 丁>丙>乙>甲
【题目】实验室制备1,2-二溴乙烷的原理:
CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
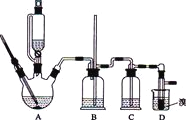
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
(1)在反应中若加热后发现未加沸石,应采取的正确方法是________________;判断该制备反应已经结束的最简单方法是_________________。
(2)装置C中应加入______________,吸收反应中产生的某些有影响的杂质气体(填写正确选项前的字母)
a.水 b.浓硫酸 c.NaOH溶液 d.KMnO4溶液
(3)装置B中竖直的长导管起安全管的作用,其原理是_____________。
(4)若产物中有少量Br2,最好用_________洗涤除去(填写正确选项前的字母)
a.水 b.乙醇 c.KI溶液 d.NaHSO3溶液
发生反应的化学方程为____________________。
(5)若产物中有少量副产物乙醚,可用__________的方法除去。
(6)反应过程中应用冷水冷却装置D,主要目的是__________________,但又不能过度冷却(如用冰水),其原因是_________________。