题目内容
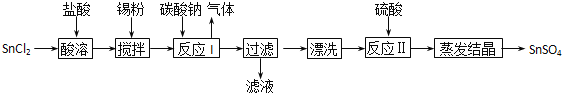
【题目】工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
(1)SnCl2用盐酸而不用水直接溶解的原因是______,加入Sn粉的作用是_______。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式_____________________。
(3)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0molL-1,则应控制溶液pH的范围是________。
(4)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
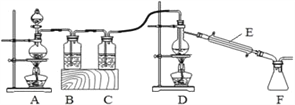
①装置C中应加入试剂为__________;仪器E的名称为__________________。
②反应开始生成SnCl4时,可以熄灭_______(填字母序号)处的酒精灯,理由是______。
③该实验装置设计尚存在缺陷,改进的方法是(包括缺少的仪器、试剂及连接位置等)______________________________________________________________。
【答案】 抑制Sn2+水解 Sn2+ + CO32-=SnO↓ + CO2↑ 防止Sn2+被氧化 小于1 浓硫酸 冷凝管 D 熔融的金属锡与氯气反应过程中放出大量的热,能维持该反应继续进行 装置D需要温度 计在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管(或U形管)
【解析】(1)SnCl2易水解生成碱式氯化亚锡,存在平衡SnCl2+H2O![]() Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2+ + CO32-=SnO↓ + CO2↑;(3)根据 Ksp[Sn(OH)2]=1.0×10-26=c(OH-)2×c(Sn2+),将c(Sn2+)=1.0mol/L代入可得c(OH-)=10-13mol/L,c(H+)=0.1mol/L,故pH小于1时Sn2+完全沉淀;(4)①氯气中含有氯化氢和水蒸气需要利用饱和食盐水和浓硫酸除去,装置B、C中的药品名称分别是饱和食盐水除去氯化氢,浓硫酸除去水蒸气;仪器E的名称为冷凝管;②该反应放热,反应开始生成SnCl4时,可以熄灭D处的酒精灯,可依靠反应放出的热量维持Sn的熔化,即:熔融的金属锡与氯气反应过程中放出大量的热,能维持该反应继续进行;③反应需控制在一定温度范围之内,装置D需要温度计;根据题意知SnCl4遇潮湿空气便发生水解反应,生成物应干燥,在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管(或U形管)。
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2+ + CO32-=SnO↓ + CO2↑;(3)根据 Ksp[Sn(OH)2]=1.0×10-26=c(OH-)2×c(Sn2+),将c(Sn2+)=1.0mol/L代入可得c(OH-)=10-13mol/L,c(H+)=0.1mol/L,故pH小于1时Sn2+完全沉淀;(4)①氯气中含有氯化氢和水蒸气需要利用饱和食盐水和浓硫酸除去,装置B、C中的药品名称分别是饱和食盐水除去氯化氢,浓硫酸除去水蒸气;仪器E的名称为冷凝管;②该反应放热,反应开始生成SnCl4时,可以熄灭D处的酒精灯,可依靠反应放出的热量维持Sn的熔化,即:熔融的金属锡与氯气反应过程中放出大量的热,能维持该反应继续进行;③反应需控制在一定温度范围之内,装置D需要温度计;根据题意知SnCl4遇潮湿空气便发生水解反应,生成物应干燥,在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管(或U形管)。

 名校课堂系列答案
名校课堂系列答案【题目】按要求填空
(1)2017年1月2日安徽六安出现了严重雾霾情况,经分析该雾霾中含有大量PM2.5、PM10、汽车尾气等等.将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | 4×10﹣5 | 3×10﹣5 | 2×10﹣5 |
根据表中数据判断PM2.5试样的pH= .
(2)在一定条件下的溶液中,反应FeCl3+3KSCNFe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,加入少量KCl固体,能使平衡移动(填“正向”、“逆向”、“不”)
(3)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,反应的离子方程式是 .
(4)常温下,一定体积PH=2的二元弱酸H2R溶液与等体积PH=12的NaOH溶液混合,该混合溶液中电荷守恒的关系式是 .
【题目】用0.1032molL﹣1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入25.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点. 其中所述操作有错误的序号为
(2)取用25.00 mL待测NaOH溶液应用以下(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“) ![]()
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失, 则会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.04 |
2 | 25.00 | 2.00 | 22.98 |
3 | 25.00 | 0.20 | 20.18 |
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
