��Ŀ����
��ҵ���õ�ⱥ��NaCl��Һ�ķ�������ȡNaOH��Cl2��H2����������Ϊԭ������һϵ�л�����Ʒ����Ϊ�ȼҵ��
��1����������Ĥ��������ʳ��ˮʱ��Cl2����NaOH��ֽӴ������²������NaClO��H2����Ĥ��������ʳ��ˮ��Ӧ�����ӷ���ʽΪ ��
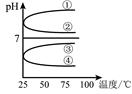
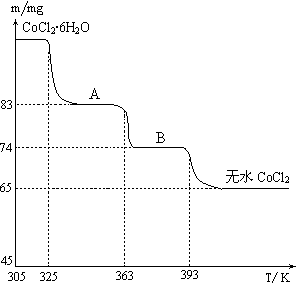
��2���ȼҵ���ܸߣ�һ�ֽ�������ȼ�ϵ������ϵ��¹��տ��Խڣ��磩��30�����ϡ������ֹ�������У�������ϵĴ�����ת����ϵ����ͼ��ʾ�����еĵ缫δ��������õ�����Ĥ��ֻ����������ͨ����
�پ����Ƶı���NaCl��ҺӦ��ͼ�е��ص� ����д���� ���ҡ�����ע�롣
��ͼ��X��____ __���ѧʽ�����������ҵĵ缫��ӦʽΪ�� _ ��ͼʾ������������Һ��������a����b���Ĺ�ϵ�� ������ĸ����
A. a%=b% B. a%��b% C. a%��b%
�ۼ��е����ӽ���ĤΪ ��������ӽ���Ĥ���������ӽ���Ĥ������
��3���ȼҵ�IJ���NaOH�벻ͬ���ʷ�Ӧ�������ɲ�ͬ���Ρ���֪�����£�Ũ�Ⱦ�Ϊ0.1 mol/L��4��������ҺpH���±���
| ���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
����˵���У�����ȷ���� ������ĸ��
a������ˮ�м���NaHCO3������������ˮ�д������Ũ��
b��������Һ�У�ˮ�ĵ���̶�������NaClO
c�������£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH������H2SO3
d��NaHSO3��Һ������Ũ�ȴ�С˳��Ϊc��Na+��> c��H+��>c��HSO3-�� >c��SO32-��>c��OH-��
��1��Cl����H2O��ClO�� + H2��
��2������ �� Cl2 O2 + 4e- + 2H2O = 4OH- C �� �����ӽ���Ĥ
��3��bcd
�������������������ˮ�м���NaHCO3��,̼�����������ᷴӦ��������ˮ�ķ�Ӧ������У�����������ˮ�д������Ũ�ȣ���ȷ��������Һ�У�ˮ�ĵ���̶�������ˮ��̶����ģ�Ҳ���Ǽ�����ǿ�ģ�ӦΪ̼���ƣ�������NaClO���������£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH������Ӧ�������������ģ�Ҳ�����������м�����ǿ��������Ӧ�������ᣬ��̼������������ᣬ����NaHSO3��Һ������Ũ�ȴ�С˳��Ϊc��Na+��>c��HSO3-��> c��H+�� >c��SO32-��>c��OH-��������
���㣺����������Һ���й�֪ʶ��

�������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�����ҺΪNa2SO3��Һ���÷�Ӧ�����ӷ���ʽ��________��
��2����֪H2SO3�ĵ��볣��ΪK1��1.54��10��2��K2��1.024��10��7��H2CO3�ĵ��볣��ΪK1��4.30��10��7��K2��5.60��10��11�������������Դ����������______������ţ���
A.CO32�� HSO3�� B. HCO3�� HSO3�� C. SO32�� HCO3�� D. H2SO3 HCO3��
��3������Һ����SO2�Ĺ����У�pH��n(SO32��):n(HSO3��)�仯��ϵ���±���
| n(SO32��):n(HSO3��) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
�ٸ����ϱ��ж�NaHSO3��Һ��_______�ԣ��Խ���ԭ��__________________________��
����NaHSO3��Һ������Ũ�ȹ�ϵ����ȷ����_______������ţ���
A��c(Na+)��2c(SO32-)+c(HSO3-)
B��c(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)
C��c(H2SO3)+ c(H+)��c(SO32-)+c(OH-)
D��c(Na+)+ c(H+)��2c(SO32-)+ c(HSO3-)+ c(OH-)
��4��������Һ��pH����ԼΪ6ʱ�����������۴�����ֱ���õ�pH��8������Һ��ѭ�����ã����ʾ��ͼ���£�
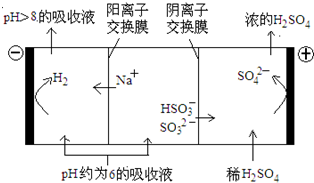
��д�������Ϸ����ĵ缫��Ӧʽ____________��
�ڵ��缫����1mol����ת��ʱ�������������Ϊ__________��
25��ʱ������ƽ�ⳣ����
| ��ѧʽ | CH3COOH | H2CO3 | HClO | H2C4H4O6(��ʯ��) | H2SO3 |
| ����ƽ�ⳣ�� | 2.0��10-5 | K1=4.3��10-7 K2=5.6��10-11 | 3.0��10-8 | K1=9.1��10-4 K2=4.3��10-5 | K1=1.3��10-2 K2=6.3��10-8 |
�ش��������⣺
��1��pH��ͬ���������ʵ���Һ��a��Na2CO3��b��NaClO��c��CH3COONa d��NaHCO3 e��Na2C4H4O6�����ʵ���Ũ���ɴ�С��˳���� ������ĸ����
��2�������£�0.1mol/L��CH3COOH��Һ��pH= ����֪lg2=0.3����
��3�������£���0.1mol/L�Ĵ�������Һ��0.1mol/L��̼������Һ�������ϣ�������Һ�и�������Ũ�ȹ�ϵ��ȷ����
A��c(Na+) �� c(ClO��) ��c(HCO3��) ��c(OH��)
B��c(Na+) �� c(HCO3��) ��c(ClO��) �� c(H+)
C��c(Na+) = c(HClO) +c(ClO��)+ c(HCO3��) + c(H2CO3)+ c(CO32��)
D��c(Na+) + c(H+)= c(ClO��)+ c(HCO3��) + 2c(CO32��)
E��c(HClO) + c(H+)+ c(H2CO3)= c(OH��) + c(CO32��)
��4��д��������CO2ͨ��NaClO��Һ�еĻ�ѧ����ʽ ��
��5��0.1mol/L�ľ�ʯ����Һ��pH=13��NaOH��Һ�������ϣ�������Һ��pHΪ6����c��HC4H4O6����+2 c��C4H4O62����= ������ȷ����ֵ��ʾ��
��ش��������⣺
��1�����ֱ�pH=2������ʹ���ϡ��100������ϡ�ͺ���Һ��pH������ ���ᣨ���������������������
��2����100mL 0.1mol?L-1��CH3COOH��Һ��50mL 0.2mol?L-1��NaOH��Һ��ϣ�������Һ�� �ԣ�ԭ���� �������ӷ���ʽ��ʾ����
��3��0.1mol��mol-1�İ�ˮ��Һ�д��ڵ���ƽ��NH3+H2O  NH3��H2O
NH3��H2O NH4++OH�����ڴ�ƽ����ϵ�иı����������±���������ɱ��пո�
NH4++OH�����ڴ�ƽ����ϵ�иı����������±���������ɱ��пո�
| | �����ı仯 | ͨ���� | ��ˮ | ��NH4Cl(s) |
| �� | ����ƽ���ƶ��ķ��� | | | |
| �� | c(OH��)�ı仯 | | | |
[�ڢ�������������ҡ����ƶ��� �ڢ������������С�����䡱]
һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棻﮻��������С�
�ӷ����л��������ܣ�CoO���Ĺ����������£�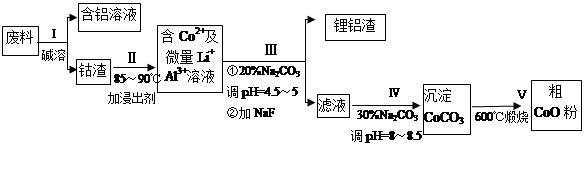
��1������I�в���NaOH��Һ�ܳ������е�Al����Ӧ�����ӷ���ʽΪ ��
��2�����̢�õ����������Ҫ�ɷ���LiF��Al(OH)3��̼������Һ�ڲ���Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ________ ____________��
��3��̼������Һ�ڹ���III��IV����������������ͬ����д���ڹ���IV����������� ��
��4����Na2CO3��Һ�д��ڶ������ӣ����и�����Ũ�ȹ�ϵ��ȷ����___ ___������ţ���
| A��c(Na+) = 2c(CO32-) |
| B��c(Na+) > c(HCO3-) > c(CO32-) |
| C��c(OH-) > c(HCO3-) > c(H+) |
| D��c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
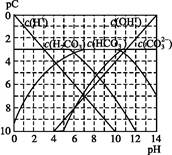
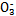 ����ʹ����ѪҺpH������7.35~7.45�����á������õ������Һ�е�ƽ�����:������������������������������(�����ӷ���ʽ��ʾ)��
����ʹ����ѪҺpH������7.35~7.45�����á������õ������Һ�е�ƽ�����:������������������������������(�����ӷ���ʽ��ʾ)�� 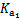 ������������
������������ 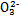 ��������������10%��������Ƽ�ʵ��֤����ͬѧ�Ĺ۵��Ƿ���ȷ
��������������10%��������Ƽ�ʵ��֤����ͬѧ�Ĺ۵��Ƿ���ȷ 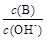 ��
�� 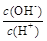 �� c��H+����c��OH-���ij˻� �� OH�������ʵ���
�� c��H+����c��OH-���ij˻� �� OH�������ʵ���