题目内容
【题目】某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要____________________。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
II.固定好滴定管并使滴定管尖嘴充满液体,调节液而至“0”或“0”刻度线以下,并记录读数
III.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
VI.用标准液滴定至终点,记录滴定管液血读数。
①上述滴定步骤中有错误的是(填编号)_________,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
②步骤IV中滴定时眼睛应________;判断滴定终点的现象是________。
③若步骤II中仰视读数,步骤IV中俯视读数,则会使测定结果____(填“偏大”、“偏小”或“无影响”)。
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=______;②烧碱样品的纯度为________%。

【答案】 500m1容量瓶 I 偏大 注视锥形瓶中溶液颜色的变化 溶液由红色刚好变为无色,且半分钟不褪色 偏小 22.60 80.80%
【解析】试题分析:(1) 配制500ml溶液时,需要500ml容量瓶,所以还需要500ml容量瓶。
(2)①滴定管用水洗涤后,还需要用标准液润洗,否则相当于稀释溶液,因此盐酸的浓度降低,消耗的盐酸溶液体积偏大,则测定结果偏高。
②步骤Ⅳ中滴定时眼睛应注视锥形瓶中溶液颜色的变化。由于选择的指示剂是酚酞,所以终点时的现象是溶液由红色刚好变为无色,且半分钟内不变色。
③若步骤II中仰视读数,则读数偏大。步骤Ⅳ中俯视读数,读数偏小,所以消耗溶液的体积偏少,因此测定结果偏小。
(3)根据滴定管的结构可知,此时的读数应该是a=22.60ml。根据表中数据可知,三次实验中消耗盐酸的体积是20.18ml、20.20ml、20.22ml,所以三次实验的平均值是20.20ml,则氢氧化钠的物质的量是0.00202mol,则纯度是![]() 。
。

【题目】《化学与生活》(1)性能各异的各种材料的广泛应用大大提高了人们的生活水平。试回答问题:
① 我国发射的“神州”系列飞船上使用了一种由我国科学家合成的新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是_____填字母)。
a.它耐高温抗氧化 b.它比钢铁轻、硬,但质地较脆 c.它是一种新型无机非金属材料
②工业制备下列物质时,不需要石灰石的是___________(填字母)。
a.玻璃 b.水泥 c.陶瓷
③材料与化学密切相关,表中对应关系正确的是_____(填字母)。
选项 | 材料 | 主要化学成分 |
a | 刚玉、金刚石 | 三氧化二铝 |
b | 大理石、石灰石 | 碳酸钙 |
c | 光导纤维、普通玻璃 | 硅酸盐 |
(2)①下图是某品牌白醋标签上的部分文字说明。
所列原料中,富含淀粉的是_________,(填序号,下同),属于防腐剂的是_______。试写出淀粉完全水解的化学方程式_____________。
原料:①水②大米③白酒④碘酒⑤苯甲酸钠
产品标准:GB18187-2000液态发酵
保质期:24个月
用途:凉拌、烹饪
酸度:≥6.00 g/100mL
②误食“工业盐”(亚硝酸钠)作为食盐引起的恶性食物中毒事故屡有发生。所以在肉制品加工中使用护色剂必须严格控制其使用量,确保食用安全。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水②碘化钾淀粉试纸③淀粉④白糖⑤白酒⑥食醋。进行实验时,必须选用的物质有____________。
(3)中共十九大报告提出:“大力推进生态文明建设”。
①南京青奥会期间使用了全生物降解塑料袋用于餐饮和处理垃圾,而不用传统的高分子材料聚乙烯、聚氯乙烯及聚苯乙烯等。制取高分子材料聚氯乙烯的单体是_________(填结构简式)。
②下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。该电化腐蚀称为______,图中A、B、C、D四个区域,生成铁锈最多的是__________(填字母)。

③汽车尾气中含有污染大气的NOx和CO。给汽车排气管加装“催化转化器”,可使CO和NOx反应生成无毒无污染的气体,反应的化学方程式为_______________。
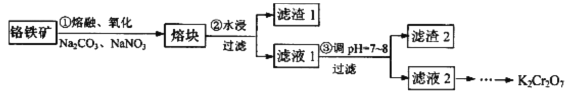
④含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72-)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72-还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的沉淀法和___________。指导老师指出该方案处理后的废水中因含有大量__________(填离子符号),能导致水体富营养化。
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3+S+5H2O![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6gNa2SO3于100mL烧杯中,加50mL去离子水搅拌溶解。
②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中,_________________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为__________________________。
(4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/LI2的标准溶液滴定,反应的离子方程式为:2S2O32-+I2=S4O62-+2I-,记录数据如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.30 | 21.32 |
2 | 0.36 | 22.56 |
3 | 0.10 | 21.08 |
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2 氧化为SO42-,该反应的离子方程式为 _____________________________。