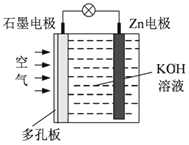
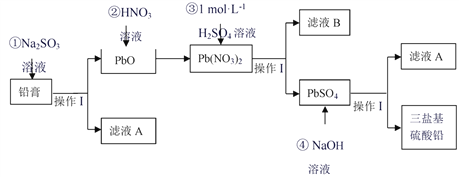
题目内容
【题目】《化学与生活》(1)性能各异的各种材料的广泛应用大大提高了人们的生活水平。试回答问题:
① 我国发射的“神州”系列飞船上使用了一种由我国科学家合成的新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是_____填字母)。
a.它耐高温抗氧化 b.它比钢铁轻、硬,但质地较脆 c.它是一种新型无机非金属材料
②工业制备下列物质时,不需要石灰石的是___________(填字母)。
a.玻璃 b.水泥 c.陶瓷
③材料与化学密切相关,表中对应关系正确的是_____(填字母)。
选项 | 材料 | 主要化学成分 |
a | 刚玉、金刚石 | 三氧化二铝 |
b | 大理石、石灰石 | 碳酸钙 |
c | 光导纤维、普通玻璃 | 硅酸盐 |
(2)①下图是某品牌白醋标签上的部分文字说明。
所列原料中,富含淀粉的是_________,(填序号,下同),属于防腐剂的是_______。试写出淀粉完全水解的化学方程式_____________。
原料:①水②大米③白酒④碘酒⑤苯甲酸钠
产品标准:GB18187-2000液态发酵
保质期:24个月
用途:凉拌、烹饪
酸度:≥6.00 g/100mL
②误食“工业盐”(亚硝酸钠)作为食盐引起的恶性食物中毒事故屡有发生。所以在肉制品加工中使用护色剂必须严格控制其使用量,确保食用安全。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水②碘化钾淀粉试纸③淀粉④白糖⑤白酒⑥食醋。进行实验时,必须选用的物质有____________。
(3)中共十九大报告提出:“大力推进生态文明建设”。
①南京青奥会期间使用了全生物降解塑料袋用于餐饮和处理垃圾,而不用传统的高分子材料聚乙烯、聚氯乙烯及聚苯乙烯等。制取高分子材料聚氯乙烯的单体是_________(填结构简式)。
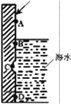
②下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。该电化腐蚀称为______,图中A、B、C、D四个区域,生成铁锈最多的是__________(填字母)。
③汽车尾气中含有污染大气的NOx和CO。给汽车排气管加装“催化转化器”,可使CO和NOx反应生成无毒无污染的气体,反应的化学方程式为_______________。
④含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72-)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72-还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的沉淀法和___________。指导老师指出该方案处理后的废水中因含有大量__________(填离子符号),能导致水体富营养化。
【答案】 b c b ② ⑤ ![]() ②⑥ CH2=CHCl 吸氧腐蚀 B 2xCO+2NOx
②⑥ CH2=CHCl 吸氧腐蚀 B 2xCO+2NOx![]() 2xCO2+N2 氧化还原法 NH4+
2xCO2+N2 氧化还原法 NH4+
【解析】试题分析:本题为《化学与生活》的综合题,侧重考查无机非金属材料,有机合成材料,人体重要的营养物质,食品添加剂,钢铁的吸氧腐蚀,汽车尾气的处理,水体污染和水的处理。
(1)①a,该材料用作航空材料说明其耐高温抗氧化,a项正确;b,该材料用作航空材料,应比钢铁轻、硬,由于该材料能增韧,质地不可能较脆,b项错误;c,该材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,是一种新型无机非金属材料,c项正确;答案选b。
②a项,制备玻璃的主要原料为纯碱、石灰石、石英;b项,制备水泥的主要原料为黏土、石灰石;c项,制备陶瓷的原料为黏土;不需要石灰石的是陶瓷,答案选c。
③a,刚玉的主要成分为Al2O3,金刚石是碳的一种同素异形体,a项错误;b,大理石、石灰石的主要成分都是CaCO3,b项正确;c,光导纤维的主要化学成分为SiO2,SiO2属于氧化物,普通玻璃的主要成分为Na2SiO3、CaSiO3、SiO2,c项错误;答案选b。
(2)①富含淀粉的是②(大米),属于防腐剂的是⑤(苯甲酸钠)。淀粉完全水解生成葡萄糖,水解的化学方程式为![]() 。
。
②根据反应2NaNO2+4HI=2NO↑+I2+2NaI+2H2O分析,NaNO2具有氧化性,酸性条件下能将I-氧化成I2,I2遇淀粉呈蓝色,NaCl不能将I-氧化,所以鉴别NaNO2和NaCl选择碘化钾淀粉试纸和食醋,答案选②⑥。
(3)①制取聚氯乙烯的方程式为nCH2=CHCl![]()
![]() ,制取聚氯乙烯的单体的结构简式为CH2=CHCl。
,制取聚氯乙烯的单体的结构简式为CH2=CHCl。
②海水呈弱碱性接近中性,铁闸在海水中的电化腐蚀称为吸氧腐蚀。钢铁发生腐蚀必须同时与O2、H2O接触,B处铁闸与O2、H2O接触最充分,生锈最快,生成铁锈最多,答案选B。
③CO与NOx反应生成无毒无污染的气体,反应生成CO2和N2,反应的化学方程式为2xCO+2NOx![]() 2xCO2+N2。
2xCO2+N2。
④(NH4)2Fe(SO4)2电离出的Fe2+将Cr2O72-还原为Cr3+,Fe2+被氧化成Fe3+,此过程为氧化还原法,发生反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;加入氨水形成难溶Cr(OH)3的离子方程式为Cr3++3NH3·H2O=Cr(OH)3↓+3NH4+,此过程为沉淀法,该方案的污水处理中用了沉淀法和氧化还原法。根据上述分析经该方案处理后的废水中因含有大量NH4+,能导致水体富营养化。

 阅读快车系列答案
阅读快车系列答案【题目】某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要____________________。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
II.固定好滴定管并使滴定管尖嘴充满液体,调节液而至“0”或“0”刻度线以下,并记录读数
III.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
VI.用标准液滴定至终点,记录滴定管液血读数。
①上述滴定步骤中有错误的是(填编号)_________,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
②步骤IV中滴定时眼睛应________;判断滴定终点的现象是________。
③若步骤II中仰视读数,步骤IV中俯视读数,则会使测定结果____(填“偏大”、“偏小”或“无影响”)。
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=______;②烧碱样品的纯度为________%。