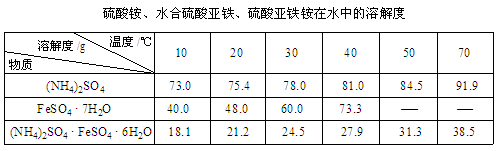
题目内容
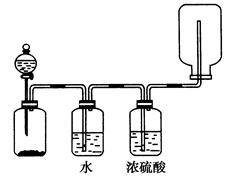
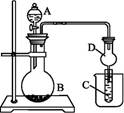
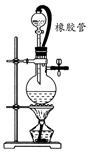
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管。下列对其作用的叙述中正确的是( )

| A.防止氯气造成大气污染 |
| B.使反应的氯气循环使用 |
| C.使烧瓶内的压强与大气压保持一致 |
| D.使分液漏斗中的液体更容易注入烧瓶 |
D
橡胶管连接的是烧瓶内体系与分液漏斗溶液以上体系,所以保证了这两个体系的压强相同,从而使分液漏斗中的液体更容易流入烧瓶。

练习册系列答案
相关题目